يمكن أن توفر العلاجات البكتيرية، التي تستخدم فيها البكتيريا الحية لتوصيل الأدوية أو غيرها من الحمولات لقتل الخلايا السرطانية، علاجًا بديلاً لمجموعة واسعة من أنواع السرطان. عندما تتسلل البكتيريا إلى جسم الإنسان، يطلق الجهاز المناعي آلية قتال ضد المادة الغريبة، وتعتمد آثار هذه الأحداث على قوة البكتيريا. ومع ذلك، فإن بعض البكتيريا بروبيوتيك، مثل كولاي Nissle 1917 (EcN)، يقاوم بسهولة خطوط دفاع الجهاز المناعي. قد يكون هذا مشكلة إذا تم النظر في مثل هذه البكتيريا للتطبيقات العلاجية.
يمكن هندسة البكتيريا الحية بحيث تقاوم جهاز المناعة، مما يؤدي إلى نتيجتين محتملتين: حدوث خلل في جهاز المناعة بعد تسليم البكتيريا؛ والبكتيريا الحية تسبب سمية للخلايا المضيفة لها. على مدى العقد الماضي، اكتشف الباحثون الحد من السمية الناجمة عن البكتيريا الحية عن طريق الحذف الوراثي لأجزاء البكتيريا التي يمكن أن تسبب السمية؛ ولكن هذا يمكن أن يؤدي إلى طفرات غير مرغوب فيها في البكتيريا نفسها وقد يقلل بشكل كبير من الفعالية العلاجية.
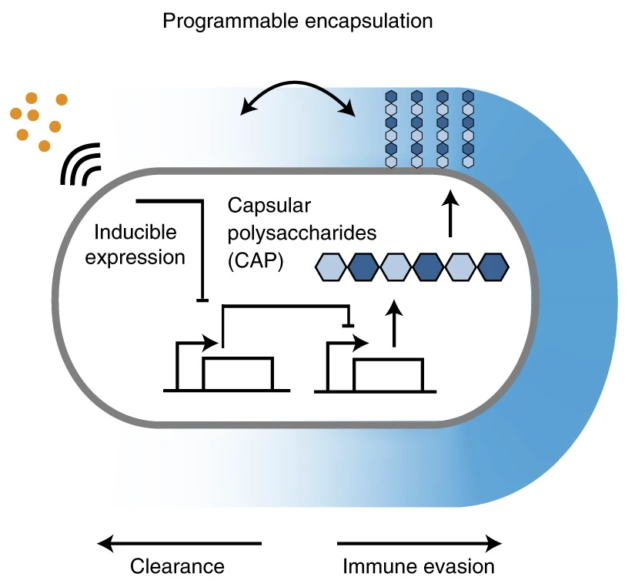
فريق من المهندسين من جامعة كولومبيا لقد حددت الآن طريقة فعالة لتعزيز توصيل البكتيريا الحية المهندسة إلى الخلايا، مع الحفاظ على سلامة البكتيريا وتقليل سميتها. الإبلاغ عن النتائج التي توصلوا إليها في طبيعة التكنولوجيا الحيويةيصف الباحثون طريقة لتغليف البكتيريا المهندسة بمادة عديد السكاريد المحفظة المحفزة (iCAP) التي تستجيب بطريقة ذكية عند وصولها إلى الجسم.
عديد السكاريد المحفظة (CAP) عبارة عن طبقة من جزيئات الماء التي تغطي سطح البكتيريا الطبيعية وتعمل كدرع ضد العدوى الأجنبية. ومن خلال تحويل CAP إلى iCAP، يمكن للباحثين تطبيق محفز خارجي قابل للبرمجة يمكّن البكتيريا المهندسة من تجنب الهجوم المناعي، والبقاء على قيد الحياة لفترة طويلة في البيئة المضيفة وتقديم جرعة علاجية مقبولة.
توجيه البكتيريا
تمتلك الخلايا السرطانية قدرة طبيعية على التهرب من جهاز المناعة، وهي إحدى السمات المميزة للسرطان. وبما أن البكتيريا المهندسة مطلوبة أيضًا لتجنب الهجوم المناعي، فإن استهداف البكتيريا للأورام يصبح مهمة شاقة، تتطلب تصميمًا متطورًا للغاية لتمكين التوطين المناسب للبكتيريا في الأورام.
استفاد الباحثون من دوائر الجينات الاصطناعية للتحكم ديناميكيًا في كيفية تفاعل البكتيريا مع البيئة المحيطة بها باستخدام iCAP. بالإضافة إلى الحماية من الضغوط البيئية وتشكيل حاجز لجدار البكتيريا، تم الإبلاغ أيضًا عن أن CAP تلعب أدوارًا مهمة في استشعار الاستجابات المناعية. للتحكم في تعبير CAP، قدم الباحثون محفزًا لجزيء صغير يسمى IPTG. أدى تحفيز CAP مع IPTG إلى تعديل تفاعلات البكتيريا مع مضادات الميكروبات المنتشرة والعاثيات البكتيرية والأحماض والجهاز المناعي المضيف.
نظام iCAP لتطبيقات السرطان
في حين تستمر العلاجات البكتيرية للسرطان في التقدم، فإن تطوير نظام قوي لقتل جميع الأورام قد يبدو أمرا لا يمكن التغلب عليه. ومع ذلك، كنقطة بداية، أثبت الباحثون أن نظام iCAP يمكنه التحكم في التوصيل العلاجي في نماذج الفئران.
للتحقق من فعالية iCAP، قام الباحثون أولاً بفحص قابلية البكتيريا للحياة في الدم البشري الكامل. ووجدوا أن البكتيريا المهندسة ظلت على قيد الحياة لفترة أطول بكثير من البكتيريا ذات CAP الطبيعي. علاوة على ذلك، بعد إعطاء الفئران بكتيريا iCAP، لاحظوا استجابات التهابية أقل مقارنة بالبكتيريا غير المعدلة وراثيًا.
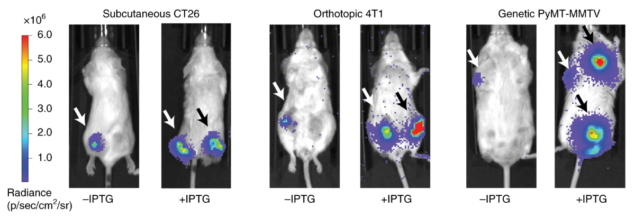
وفي الفئران الحاملة للورم، مكّن iCAP أيضًا من نقل البكتيريا العلاجية إلى أورام بعيدة متعددة في جميع أنحاء الجسم، مع زيادة الاتجار مقارنة بالبكتيريا الطبيعية. بالإضافة إلى ذلك، أدى تقديم بنية EcN iCAP المصممة لإنتاج سم مضاد للورم إلى انخفاض نمو الورم في الفئران، مما يدل على فعاليته العلاجية.
تل دانينو، المؤلف الرئيسي لهذه الدراسة، يخطط الآن لمواصلة استكشاف استخدام iCAP وغيرها من العلاجات البكتيرية لتسريع الترجمة السريرية في المستقبل.
وظيفة البكتيريا القاتلة للسرطان تتهرب من جهاز المناعة ظهرت للمرة الأولى على عالم الفيزياء.
- 10
- a
- القدرة
- تسريع
- إدارة
- تقدم
- ضد
- الكل
- البديل
- التطبيقات
- التقديم
- نهج
- الكتاب
- حاجز
- يجري
- اسود
- دم
- الجسدي
- سبب
- مما تسبب في
- مقارنة
- استمر
- مراقبة
- استطاع
- عقد
- دفاع
- تم التوصيل
- تقديم
- التوصيل
- تظاهر
- تابع
- نشر
- وصف
- تصميم
- تطوير
- توزيع
- المخدرات
- بسهولة
- الطُرق الفعّالة
- تمكين
- تمكن
- المهندسين
- البيئة
- بيئي
- أحداث
- اكتشف
- الاسم الأول
- أجنبي
- وجدت
- تبدأ من
- إضافي
- علاوة على ذلك
- مستقبل
- التسويق
- جدا
- كيفية
- لكن
- HTTPS
- الانسان
- صورة
- صور
- أهمية
- زيادة
- سلامة
- بحث
- نفسها
- طبقة
- قيادة
- ليد
- خطوط
- حي
- الذين يعيشون
- موقع
- أسلوب
- آلية
- ربما
- عارضات ازياء
- متعدد
- طبيعي
- الطبيعة
- أخرى
- خطط
- بلايستشن
- البوينت
- محتمل
- إنتاج
- تزود
- نطاق
- مطلوب
- الباحثين
- مما أدى
- إظهار
- هام
- منذ
- سمارت
- بعض
- متطور
- حافز
- دراسة
- مادة
- المساحة
- نظام
- استهداف
- فريق
- •
- طوال
- خدمات ترجمة
- علاج
- تستخدم
- مختلف
- مياه
- في حين