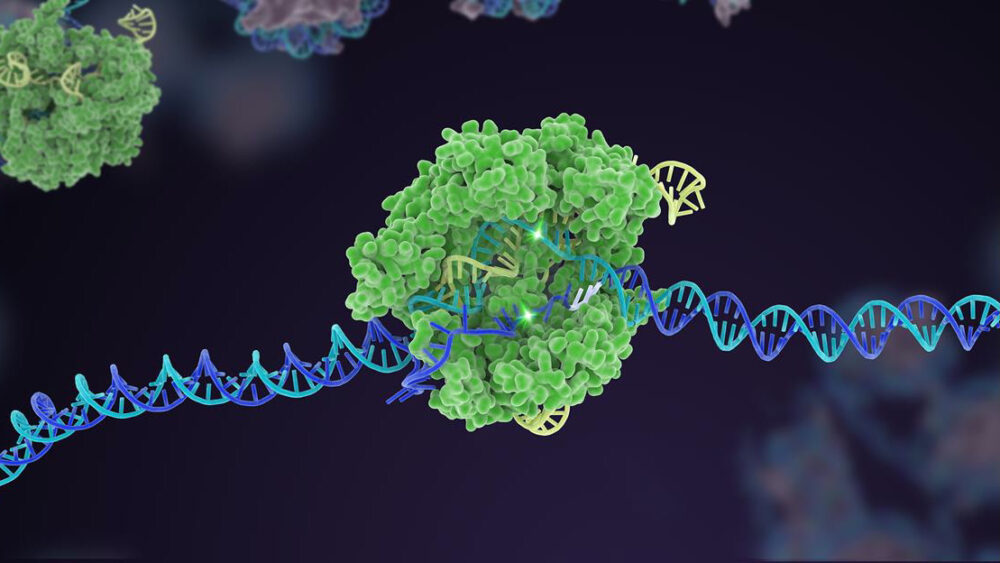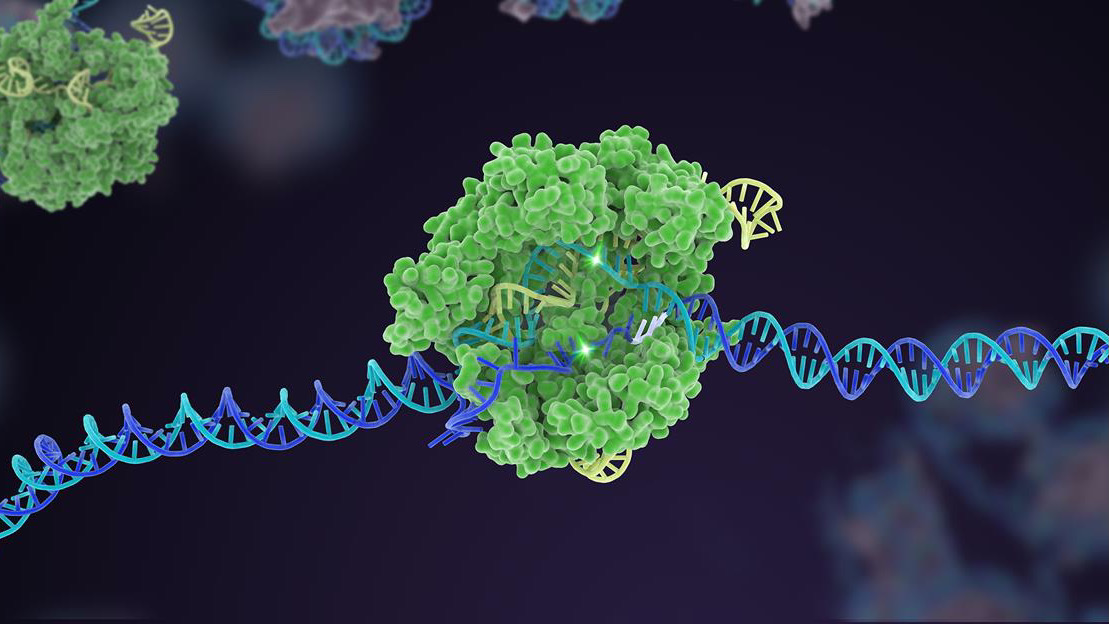
قبل عشر سنوات ، قفزت آلية دفاع بكتيرية غير معروفة كثيرًا إلى الشهرة كمحرر قوي للجينوم. في العقد الذي تلا ذلك ، ابتكرت تقنية CRISPR-Cas9 متغيرات متعددة ، وتوسعت في صندوق أدوات شامل يمكنه تعديل الشفرة الجينية للحياة.
بعيدًا عن السعي وراء برج عاجي ، جاءت استخداماته العملية في البحث والرعاية الصحية والزراعة سريعة وغاضبة.
لقد رأيت العناوين الرئيسية. وافقت ادارة الاغذية والعقاقير على استخدامه في معالجة الطفرة الجينية الكامنة وراء مرض فقر الدم المنجلي. بعض الباحثين تحرير الخلايا المناعية لمحاربة سرطانات الدم غير القابلة للعلاج عند الأطفال. تولى الآخرون زرع الأعضاء من خنزير إلى إنسان من الحلم إلى الواقع في محاولة لتخفيف النقص في الأعضاء المانحة. يهدف العمل الأخير إلى مساعدة الملايين من الأشخاص الذين يعانون من ارتفاع الكوليسترول - وربما جلب العلاج الجيني المستند إلى CRISPR إلى الجماهير - عن طريق تقليل فرص الإصابة بأمراض القلب بحقنة واحدة.
لكن بالنسبة إلى الدكتورة جينيفر دودنا ، الحائزة على جائزة نوبل في عام 2020 لدورها في تطوير تقنية كريسبر ، فإننا فقط نخدش سطح إمكاناتها. جنبا إلى جنب مع طالبة الدراسات العليا جوي وانغ ، وضعت Doudna خارطة طريق للعقد القادم للتكنولوجيا في مقال in علوم.
إذا كان العقد الأول من القرن الحادي والعشرين يركز على إنشاء صندوق أدوات كريسبر وإثبات فعاليته ، فإن هذا العقد هو الوقت الذي تصل فيه التكنولوجيا إلى كامل إمكاناتها. من العلاجات القائمة على كريسبر والشاشات واسعة النطاق لتشخيص الأمراض إلى هندسة المحاصيل عالية الإنتاجية والأطعمة المغذية ، فإن التكنولوجيا "وتأثيرها المحتمل لا يزالان في مراحلهما الأولى" ، كما كتب المؤلفون.
عقد من الملامح البارزة
لقد سكبنا الكثير من الحبر على تطورات تقنية كريسبر ، ولكن من المفيد إعادة النظر في الماضي للتنبؤ بالمستقبل - وربما اكتشاف المشكلات على طول الطريق.
كانت إحدى أبرز الأحداث المبكرة هي قدرة كريسبر المذهلة على هندسة نماذج حيوانية للأمراض بسرعة. يزيل شكله الأصلي بسهولة جينًا مستهدفًا في جنين مبكر جدًا ، والذي عند زرعه في الرحم يمكن أن يولد فئرانًا معدلة وراثيًا في غضون شهر واحد فقط ، مقارنةً بعام باستخدام الأساليب السابقة. عززت إصدارات CRISPR الإضافية ، مثل تحرير القاعدة - تبديل حرف جيني بآخر - والتحرير الأولي - الذي يقص الحمض النووي دون قطع كلا الخيطين - مرونة مجموعة الأدوات في هندسة العضيات المعدلة وراثيًا (فكر في أدمغة صغيرة) والحيوانات. أنشأ كريسبر بسرعة العشرات من النماذج لبعض الأمراض الأكثر تدميراً وإرباكاً لدينا ، بما في ذلك أنواع مختلفة من السرطان ، والزهايمر ، وضمور دوشين العضلي - وهو اضطراب تنكسي تتلاشى فيه العضلات ببطء. العشرات من التجارب المستندة إلى CRISPR هي الآن في أعمال.
كما سرَّعت تقنية "كريسبر" الفحص الجيني في عصر البيانات الضخمة. بدلاً من استهداف جين واحد في كل مرة ، أصبح من الممكن الآن إسكات أو تنشيط آلاف الجينات بالتوازي ، لتشكيل نوع من حجر رشيد لترجمة الاضطرابات الجينية إلى تغييرات بيولوجية. هذا مهم بشكل خاص لفهم التفاعلات الجينية ، مثل تلك الموجودة في السرطان أو الشيخوخة التي لم نكن مطلعين عليها من قبل ، واكتساب ذخيرة جديدة لتطوير الأدوية.
لكن أحد الإنجازات المتتالية لـ CRISPR كان التحرير متعدد الإرسال. مثل النقر في وقت واحد على مفاتيح البيانو المتعددة ، يستهدف هذا النوع من الهندسة الوراثية مناطق DNA محددة متعددة ، مما يغير بسرعة التركيب الجيني للجينوم دفعة واحدة.
تعمل التكنولوجيا في النباتات والحيوانات. على مدى دهور ، قام الناس بتربية المحاصيل بشق الأنفس ذات السمات المرغوبة - سواء كان ذلك اللون ، أو الحجم ، أو المذاق ، أو التغذية ، أو مقاومة الأمراض. يمكن أن تساعد تقنية CRISPR في الاختيار لصفات متعددة أو حتى تدجين محاصيل جديدة في جيل واحد فقط. ولدت كريسبر ثيران بلا قرون, طماطم غنية بالمغذيات، وحيوانات المزرعة شديدة العضلات والسمك هي بالفعل حقيقة واقعة. مع سكان العالم لتصل إلى 8 مليارات في عام 2022 و الملايين يعانون من الجوع، قد توفر المحاصيل المتوافقة مع تقنية CRISPRed شريان حياة - أي إذا كان الناس على استعداد لقبول التكنولوجيا.
الطريق إلى الأمام
أين نذهب من هنا؟
بالنسبة للمؤلفين ، نحتاج إلى زيادة تعزيز فعالية كريسبر وبناء الثقة. هذا يعني العودة إلى الأساسيات لزيادة دقة ودقة تحرير الأداة. هنا ، تعتبر المنصات التي تعمل على التطور السريع لإنزيمات Cas ، المكون "المقص" لآلة CRISPR ، أمرًا بالغ الأهمية.
لقد كانت هناك بالفعل نجاحات: إصدار Cas واحد ، مثلا، بمثابة حاجز حماية لمكون الاستهداف - sgRNA "كلب الصيد". في CRISPR الكلاسيكي ، يعمل sgRNA بمفرده ، لكن في هذا الإصدار المحدث ، يكافح من أجل الارتباط بدون مساعدة Cas. تساعد هذه الحيلة في تخصيص التحرير لموقع DNA معين وتزيد من الدقة بحيث يعمل القطع كما هو متوقع.
يمكن للاستراتيجيات المماثلة أيضًا تعزيز الدقة مع تقليل الآثار الجانبية أو إدخال جينات جديدة في الخلايا مثل الخلايا العصبية وغيرها التي لم تعد تنقسم. في حين أن التحرير الأولي ممكن بالفعل ، إلا أن كفاءته يمكن أن تكون كذلك 30 مرات أقل من آليات كريسبر الكلاسيكية.
قال المؤلفون: "إن الهدف الرئيسي للتحرير الأولي في العقد المقبل هو تحسين الكفاءة دون المساومة على نقاء تحرير المنتج - وهي نتيجة لديها القدرة على تحويل التحرير الأولي إلى واحد من أكثر الأدوات تنوعًا للتحرير الدقيق".
ولكن ربما يكون الأمر الأكثر أهمية هو الولادة ، التي تظل عنق الزجاجة خاصة بالنسبة للعلاجات. حاليًا ، تُستخدم كريسبر عمومًا على الخلايا خارج الجسم التي يتم ضخها في الخلف - كما في حالة CAR-T - أو في بعض الحالات ، مقيدة بحاملة فيروسية أو مغلفة في فقاعات دهنية ويتم حقنها في الجسم. كانت هناك نجاحات: في القرن الرابع الميلادي، وافقت ادارة الاغذية والعقاقير على أول لقطة تعتمد على تقنية كريسبر لمعالجة مرض الدم الوراثي ، الداء النشواني ترانستيريتين.
ومع ذلك ، فإن كلا الاستراتيجيتين إشكاليتان: فليس هناك أنواع كثيرة من الخلايا يمكنها النجاة من علاج CAR-T - تموت عند إعادة إدخالها في الجسم - ولا يزال استهداف أنسجة وأعضاء معينة بعيدًا عن متناول العلاجات القابلة للحقن.
قال المؤلفون إن التقدم الرئيسي في العقد المقبل هو نقل شحنة كريسبر إلى الأنسجة المستهدفة دون إلحاق الأذى وإطلاق محرر الجينات في المكان المقصود. تقدم كل خطوة من هذه الخطوات ، على الرغم من أنها تبدو بسيطة على الورق ، مجموعتها الخاصة من التحديات التي تتطلب الهندسة الحيوية والابتكار للتغلب عليها.
أخيرًا ، يمكن لـ CRISPR أن تتآزر مع التطورات التكنولوجية الأخرى ، كما قال المؤلفون. على سبيل المثال ، من خلال الاستفادة من التصوير الخلوي والتعلم الآلي ، يمكننا قريبًا هندسة المزيد من محرري الجينوم الأكثر كفاءة. شكرا ل تسلسل الحمض النووي أسرع وأرخص، يمكننا بعد ذلك بسهولة مراقبة نتائج تعديل الجينات. يمكن أن توفر هذه البيانات بعد ذلك نوعًا من آلية التغذية الراجعة التي يمكن بواسطتها هندسة محرري جينوم أكثر قوة في حلقة فعالة.
تأثير العالم الحقيقي
على الرغم من أن توسيع صندوق أدوات CRISPR على جدول الأعمال ، إلا أن التكنولوجيا ناضجة بما يكفي للتأثير على العالم الحقيقي في عقدها الثاني ، كما قال المؤلفون.
في المستقبل القريب ، يجب أن نرى "عددًا متزايدًا من العلاجات القائمة على كريسبر تنتقل إلى مراحل لاحقة من التجارب السريرية." بالنظر إلى المستقبل ، يمكن أن تجعل التكنولوجيا ، أو متغيراتها ، عمليات زرع الأعضاء من خنزير إلى إنسان أمرًا روتينيًا ، وليس تجريبيًا. يمكن للفحص على نطاق واسع للجينات التي تؤدي إلى الشيخوخة أو أمراض الدماغ أو القلب التنكسية - أهم الأمراض القاتلة لدينا اليوم - أن تسفر عن علاجات وقائية تعتمد على تقنية كريسبر. إنها ليست مهمة سهلة: نحن بحاجة إلى معرفة الجينات الكامنة وراء الأمراض الوراثية متعددة الأوجه - أي عندما تلعب جينات متعددة - وطريقة لإيصال أدوات التحرير إلى هدفها. قال المؤلفون: "لكن الفوائد المحتملة قد تدفع الابتكار في هذه المجالات إلى ما هو أبعد مما هو ممكن اليوم".
لكن مع القوة الأكبر تأتي مسؤولية أكبر. تقدمت تقنية CRISPR بسرعة فائقة ، ولا تزال الهيئات التنظيمية والجمهور يكافحون من أجل اللحاق بالركب. ربما كان أشهر مثال على ذلك هو مثال أطفال كريسبر، حيث أجريت التجارب ضد المبادئ التوجيهية الأخلاقية العالمية دفعت كونسورتيوم دولي لوضع خط أحمر لتحرير الخلايا الجرثومية البشرية.
وبالمثل ، لا تزال الكائنات المعدلة وراثيًا (GMOs) موضوعًا مثيرًا للجدل. على الرغم من أن تقنية CRISPR أكثر دقة بكثير من الأدوات الجينية السابقة ، إلا أن الأمر متروك للمستهلكين ليقرروا ما إذا كانوا سيرحبون بهم أم لا جيل جديد من الأطعمة التي طورها الإنسان- كلا من النبات والحيوان.
وهذه هي المحادثات الهامة التي تحتاج إلى خطاب عالمي بينما تدخل تقنية CRISPR عقدها الثاني. لكن بالنسبة للمؤلفين ، يبدو المستقبل مشرقًا.
وقالوا: "تمامًا كما حدث أثناء ظهور تعديل الجينوم بتقنية كريسبر ، فإن مزيجًا من الفضول العلمي والرغبة في إفادة المجتمع سيقود العقد القادم من الابتكار في تقنية كريسبر". "من خلال الاستمرار في استكشاف العالم الطبيعي ، سنكتشف ما لا يمكن تخيله ونستخدمه في العالم الحقيقي لصالح الكوكب."
الصورة الائتمان: المعاهد الوطنية للصحة
- محتوى مدعوم من تحسين محركات البحث وتوزيع العلاقات العامة. تضخيم اليوم.
- بلاتوبلوكشين. Web3 Metaverse Intelligence. تضخيم المعرفة. الوصول هنا.
- المصدر https://singularityhub.com/2023/01/25/crisprs-wild-first-decade-only-scratches-the-surface-of-its-potential/
- 2020
- a
- القدرة
- معجل
- استمر
- دقة
- إنجاز
- الأفعال
- إضافي
- تقدم
- متقدم
- السلف
- مجيء
- ضد
- وكالات
- جدول أعمال
- • التقدم في العمر.
- زراعة
- قدما
- وتهدف
- تخفيف
- وحده
- سابقا
- بالرغم ان
- الزهايمر
- ذخيرة
- و
- حيوان
- الحيوانات
- من وزارة الصحة
- المناطق
- مساعدة
- الكتاب
- الى الخلف
- قاعدة
- الأساسيات
- تستفيد
- الفوائد
- بيركلي
- Beyond
- كبير
- البيانات الكبيرة
- مليار
- ربط
- دم
- بلومبرغ
- الجسدي
- زيادة
- عززت
- دماغ
- جلب
- نساعدك في بناء
- بناء الثقة
- السرطان.
- لا تستطيع
- حقيبة
- الحالات
- يو كاتش
- خلايا
- التحديات
- فرص
- التغييرات
- متغير
- أرخص
- كلاسيكي
- سريري
- التجارب السريرية
- الكود
- اللون
- مجموعة
- تأتي
- مقارنة
- عنصر
- شامل
- مساومة
- النتائج
- جمعية
- المستهلكين
- استمرار
- المثير للجدل
- المحادثات
- استطاع
- ائتمان
- كريسبر
- حرج
- المحاصيل
- فضول
- حاليا
- قطع
- قطع
- البيانات
- عقد
- الدفاع
- نقل
- التوصيل
- تطوير
- التطوير التجاري
- اكتشف
- مرض
- الأمراض
- الحمض النووي
- إلى أسفل
- عشرات
- حلم
- قيادة
- عقار
- أثناء
- كل
- في وقت مبكر
- بسهولة
- رئيس التحرير
- فعالية
- الآثار
- كفاءة
- فعال
- مغلفة
- مهندس
- الهندسة
- يدخل
- خاصة
- أنشئ
- تأسيس
- أخلاقي
- حتى
- يتطور
- مثال
- توسيع
- اكتشف
- FAME
- مزرعة
- FAST
- ادارة الاغذية والعقاقير
- ردود الفعل
- حارب
- الاسم الأول
- مرونة
- ركز
- الأطعمة
- النموذج المرفق
- تبدأ من
- بالإضافة إلى
- إضافي
- مستقبل
- كسب
- على العموم
- توليد
- جيل
- الهندسة الوراثية
- علم الوراثة
- العالمية
- Go
- هدف
- الذهاب
- خريج
- أكبر
- المبادئ التوجيهية
- عناوين
- الرعاية الصحية
- قلب
- مساعدة
- يساعد
- هنا
- مرتفع
- تسليط الضوء
- HTTPS
- الانسان
- التصوير
- التأثير
- أهمية
- تحسين
- in
- بما فيه
- القيمة الاسمية
- زيادة
- الزيادات
- لا يصدق
- الابتكار
- التفاعلات
- عالميا
- IT
- جينيفر
- واحد فقط
- القفل
- مفاتيح
- القتلة
- نوع
- المعرفة
- على نطاق واسع
- قيادة
- تعلم
- إقراض
- خطاب
- الحياة
- خط
- يعد
- أبحث
- تبدو
- آلة
- آلة التعلم
- آلية
- الرئيسية
- جعل
- ماكياج
- كثير
- ناضج
- يعني
- آلية
- طرق
- ملايين
- عارضات ازياء
- تم التعديل
- مراقبة
- شهر
- الأكثر من ذلك
- أكثر فعالية
- أكثر
- يتحرك
- متعدد الأوجه
- متعدد
- طبيعي
- الطبيعة
- قرب
- حاجة
- الخلايا العصبية
- جديد
- التالي
- NHS
- المعاهد الوطنية للصحة
- جائزة نوبل
- سيئة السمعة
- عدد
- ONE
- أصلي
- أخرى
- أخرى
- في الخارج
- تغلب
- الخاصة
- ورق
- موازية
- الماضي
- مسار
- بلد
- مجتمع
- ربما
- كوكب
- الشتلات
- منصات التداول
- أفلاطون
- الذكاء افلاطون البيانات
- أفلاطون داتا
- وفرة
- سكان
- ممكن
- محتمل
- يحتمل
- قوة
- قوي
- عملية
- دقة
- تنبأ
- وتوقع
- الهدايا
- سابق
- سابقا
- رئيسي
- جائزة
- مشاكل
- منتج
- تزود
- جمهور
- وضع
- بسرعة
- الوصول
- يصل
- حقيقي
- العالم الحقيقي
- واقع
- الأخيرة
- أحمر
- المنظمين
- الافراج عن
- لا تزال
- بقايا
- تطلب
- بحث
- الباحثين
- مرونة
- مسؤولية
- النوادي الثرية
- خريطة طريق
- النوع
- قال
- علوم
- كشاف
- الفحص
- شاشات
- الثاني
- طقم
- نقص
- ينبغي
- جانب
- الصمت
- الاشارات
- معا
- منذ
- عزباء
- الموقع
- حجم
- ببطء
- So
- جاليات
- بعض
- محدد
- سرعة
- بقعة
- نسج
- مراحل
- خطوات
- لا يزال
- STONE
- استراتيجيات
- النضالات
- يكافح
- طالب
- هذه
- معاناة
- المساحة
- البقاء على قيد الحياة
- الهدف
- المستهدفة
- استهداف
- الأهداف
- مهمة
- التكنولوجية
- تكنولوجيا
- •
- أساسيات
- العالم
- من مشاركة
- العلاجات
- الآلاف
- الوقت
- مرات
- إلى
- اليوم
- سويا
- الأدوات
- أدوات
- تيشرت
- موضوع
- برج
- محاكمات
- الثقة
- منعطف أو دور
- أنواع
- UN
- التي تقوم عليها
- فهم
- تحديث
- تستخدم
- مختلف
- متعدد الجوانب
- الإصدار
- ترحيب
- ابحث عن
- ما هي تفاصيل
- سواء
- التي
- في حين
- من الذى
- بري
- سوف
- مستعد
- بدون
- وون
- للعمل
- أعمال
- العالم
- عام
- سنوات
- التوزيعات للسهم الواحد
- زفيرنت