العلاج المناعي - الذي يستخدم جهاز المناعة في الجسم لمحاربة السرطان - لديه القدرة على إحداث ثورة في رعاية مرضى السرطان. ولكن بينما تستجيب سرطانات الدم مثل اللوكيميا والأورام اللمفاوية بشكل جيد للعلاج المناعي للسرطان ، فإن الأورام الصلبة تظهر استجابة محدودة.
أحد الأسباب المحتملة لهذا التفاوت هو التعبير المتنوع للبروتينات السطحية في السرطانات المختلفة. على سبيل المثال ، البروتين المرتبط بالغشاء SLAMF7 - الذي ينشط الجهاز المناعي ويحفز البلعمة (ابتلاع) الخلايا السرطانية بواسطة الخلايا المناعية - يتم التعبير عنه بواسطة خلايا سرطان الدم ، ولكن ليس بالأورام الصلبة.
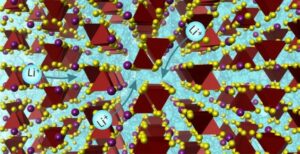
بهدف جعل الخلايا السرطانية الصلبة أكثر تقبلا للعلاج المناعي ، كما قال باحثون مركز جامعة تكساس أندرسون للسرطان طوروا منصة لتكنولوجيا النانو تطلق تعبيرهم عن SLAMF7. موضح في طبيعة التكنولوجيا النانوية، يعتمد النظام الأساسي على الجسيمات النانوية المحولة للورم ثنائية الخصوصية (BiTNs) التي تتكون من نواة بوليمرية مترافقة مع روابط تستهدف الورم و SLAMF7.
"مع هذه المنصة الجديدة ، لدينا الآن إستراتيجية لتحويل الورم الصلب ، على الأقل من الناحية المناعية ، ليشبه ورم الدم ، والذي غالبًا ما يكون له معدل استجابة أعلى بكثير للعلاجات المناعية ،" وين جيانغ، الذي شارك في قيادة الدراسة مع بيتي كيم. "إذا كنا قادرين على ترجمة هذا النهج والتحقق من صحته في العيادة ، فقد يمكننا من الاقتراب من الحد الأقصى لمستوى النشاط من أدوية العلاج المناعي مع السرطانات التي لم تستجيب بشكل تقليدي بشكل جيد."
في المختبر و في الجسم الحي التقييم المناسبين
قام الباحثون أولاً بالتحقيق في المنصة المختبرباستخدام خلايا سرطان الثدي إيجابية HER2. لقد ابتكروا BiTNs الخاصة بالخلايا لهذا التطبيق عن طريق اقتران الجسيمات النانوية بالأجسام المضادة لـ HER2 لربط الخلايا السرطانية ، و SLAMF7 لتنشيط الاستجابة المناعية. اقتران النانو الناتج - BiTNلها - استهدفت بشكل انتقائي خلايا سرطان الثدي إيجابية HER2 ووصفها بـ SLAMF7.
وأكد الفريق أن BiTNلهاأثارت الخلايا السرطانية الموسومة مستوى أعلى من البلعمة مقارنة بالجسيمات النانوية غير المقترنة. BiTNلها قام أيضًا بتوعية خلايا سرطان الثدي للعلاج بجسم مضاد لـ CD47 ، والذي يمنع إشارة "لا تأكلني" من الخلايا السرطانية ، مما يزيد من نشاط البلعمة.
بعد ذلك ، قام الفريق بتقييم BiTNلها في الفئران المصابة بأورام سرطان الثدي من خلايا TUBO ، التي تعبر عن نسخة القوارض من HER2 ، أو خلايا 4T1 التي تفتقر إلى هذا المستقبل. العلاج باستخدام BiTNلها بالإضافة إلى مضادات CD47 ، قللت بشكل كبير من عبء الورم وأطالت بقاء الفئران المصابة بأورام TUBO ؛ لم يلاحظ التأثير المضاد للورم في أورام 4T1.
لاحظ الباحثون أن العلاج المركب أدى إلى تثبيط الورم بشكل كبير مقارنةً بـ BiTNs أو مضاد CD47 وحده. وجدت دراسة سمية طويلة المدى عدم وجود فرق كبير في تعداد الدم بين الفئران غير المعالجة والمعالجة.
لإثبات تنوع منصة BiTN ، قام الباحثون بتخصيص الجسيمات النانوية لاستهداف مستقبل ورم آخر - مستقبل الفولات الذي يعبر عنه سرطان الثدي الثلاثي السلبي. أنشأوا BiTNFo عن طريق استبدال الجسم المضاد لـ HER2 بحمض الفوليك. BiTNFo تستهدف الخلايا السرطانية وتحولها إلى خلايا معبرة عن SLAMF7. كما هو متوقع ، احتضان خلايا 4T1 مع BiTNFo ومضاد CD47 أدى إلى حدوث بلعمة أكبر مما لوحظ في خلايا TUBO.
يقول كيم في بيان صحفي: "نظرًا لأن هذه التركيبات مُصممة هندسيًا ، يمكن استخدام ذلك كنهج للتشغيل والتشغيل لدمج عوامل مختلفة لاستهداف الورم أو جزيئات مناعية على سطح الجسيمات النانوية".
اختبر الباحثون أيضًا BiTNFo في نموذج ماوس ورم خبيث تلقائي 4T1 ، يعالج الأورام الأولية باستخدام BiTNFo ومضاد CD47 قبل الاستئصال الجراحي. منع هذا المزيج من تكرار المرض المحلي ولكنه لم يقلل من النقائل البعيدة أو يطيل البقاء على قيد الحياة بشكل عام. ومع ذلك ، أدت إضافة مضادات PD1 إلى العلاج إلى تثبيط ورم خبيث لفترات طويلة ، حيث أظهر اثنان من الفئران السبعة نجاة طويلة الأمد خالية من الورم.

يعالج العلاج المناعي بالإضافة إلى موجة من الإشعاع أورام المخ لدى الفئران
أخيرًا ، لزيادة تعزيز الصلة الترجمية لهذا النموذج ، حقق الفريق في نظام علاج ما بعد الجراحة. هنا ، تم استئصال أورام الفئران في اليوم الثاني عشر دون أي علاج مسبق ، ومن ثم ابتداءً من اليوم الخامس عشر ، عولجت الحيوانات بالمزيج الثلاثي من BiTN.Fo، ومكافحة CD47 ومكافحة PD1. أدى هذا العلاج اللاحق للعمليات الجراحية إلى تثبيط النقائل وإطالة مدة البقاء على قيد الحياة - مما يشير إلى أنه حتى بدون علاج داخل الورم ، يمكن أن تساعد BiTNs في القضاء على خلايا الورم المتبقية وتقليل الأمراض الجهازية.
بعد ذلك ، يركز الباحثون على ترجمة هذه التكنولوجيا الجديدة إلى العيادة. يقول جيانغ: "لتسهيل الترجمة السريرية ، نستكشف استراتيجية قائمة على البروتين سنطور فيها بروتينًا ثنائي الخصوصية يمكن أن يعمل بشكل مشابه لـ BiTN". عالم الفيزياء. "سيتطلب هذا بعض هندسة البروتين / الأجسام المضادة ولكن من المحتمل أن يكون من الأسهل تلبية الموافقات التنظيمية."