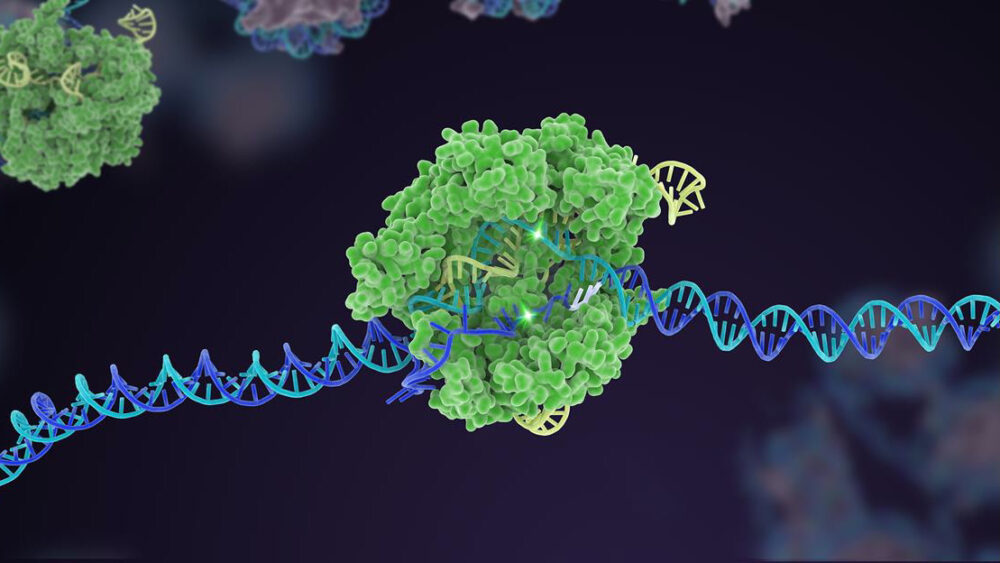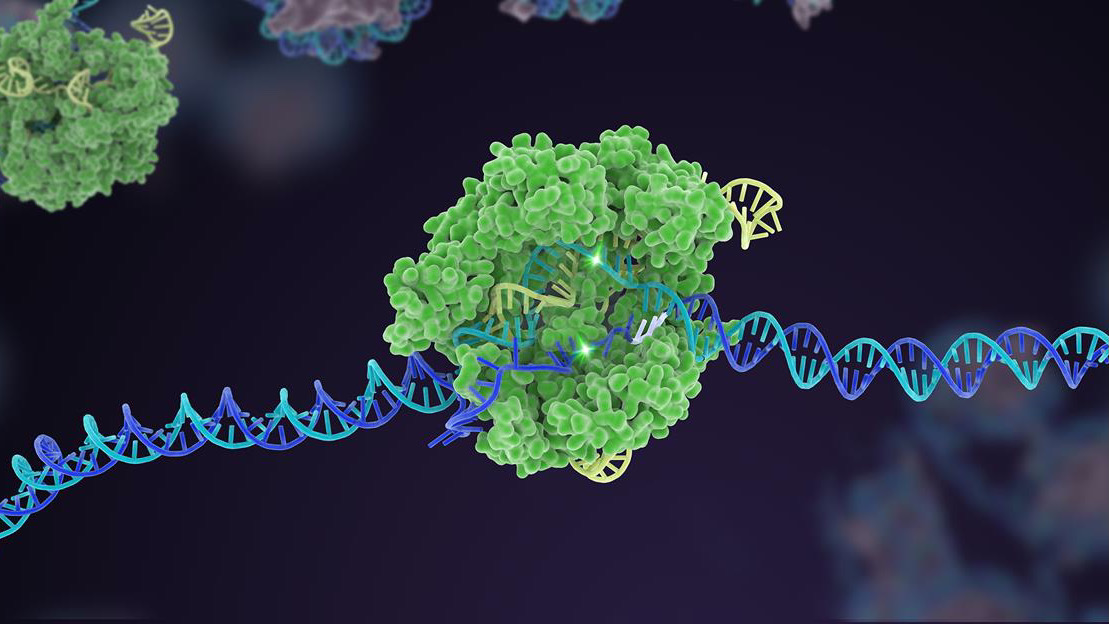
For ti år siden steg en lidet kendt bakteriel forsvarsmekanisme til berømmelse som en kraftfuld genom-editor. I årtiet siden har CRISPR-Cas9 udvundet flere varianter og udvidet til en omfattende værktøjskasse, der kan redigere livets genetiske kode.
Langt fra et elfenbenstårn-udøvelse, dets praktiske anvendelser i forskning, sundhedspleje og landbrug kom hurtigt og rasende.
Du har set overskrifterne. FDA godkendte dets anvendelse i tackling af den underliggende genetiske mutation for seglcellesygdom. Nogle forskere redigerede immunceller til at bekæmpe ubehandlet blodkræft hos børn. Andre tog organtransplantationer fra svin til menneske fra drøm til virkelighed i et forsøg på at afhjælpe manglen på donororganer. Det seneste arbejde sigter mod at hjælpe millioner af mennesker med højt kolesteroltal – og potentielt bringe CRISPR-baseret genterapi til masserne – ved at sænke deres chancer for hjertesygdomme med en enkelt injektion.
Men til Dr. Jennifer Doudna, som vandt Nobelprisen i 2020 for sin rolle i udviklingen af CRISPR, vi ridser bare i overfladen af dets potentiale. Sammen med kandidatstuderende Joy Wang lagde Doudna en køreplan for teknologiens næste årti i en artikel in Videnskab.
Hvis 2010'erne var fokuseret på at etablere CRISPR-værktøjskassen og bevise dens effektivitet, er dette årti, når teknologien når sit fulde potentiale. Fra CRISPR-baserede terapier og storskala screeninger til sygdomsdiagnostik til konstruktion af højudbytte afgrøder og nærende fødevarer, teknologien "og dens potentielle virkning er stadig i deres tidlige stadier," skrev forfatterne.
Et årti med højdepunkter
Vi har spildt masser af blæk på CRISPR-fremskridt, men det betaler sig at gense fortiden for at forudsige fremtiden – og potentielt spejde ud af problemer undervejs.
Et tidligt højdepunkt var CRISPRs utrolige evne til hurtigt at konstruere dyremodeller for sygdom. Dens oprindelige form fjerner let et målrettet gen i et meget tidligt embryo, som, når det transplanteres ind i en livmoder, kan generere genetisk modificerede mus på kun en måned sammenlignet med et år ved hjælp af tidligere metoder. Yderligere CRISPR-versioner, såsom basisredigering - udskiftning af et genetisk bogstav med et andet - og prime redigering - som klipper DNA'et uden at skære begge strenge - øgede yderligere værktøjskassens fleksibilitet til at konstruere genetisk ændrede organoider (tænk mini-hjerne) og dyr. CRISPR etablerede hurtigt snesevis af modeller for nogle af vores mest ødelæggende og forvirrende sygdomme, herunder forskellige kræftformer, Alzheimers og Duchennes muskeldystrofi – en degenerativ lidelse, hvor musklen langsomt forsvinder. Dusinvis af CRISPR-baserede forsøg er nu i værkerne.
CRISPR accelererede også genetisk screening ind i big data-alderen. I stedet for at målrette mod ét gen ad gangen, er det nu muligt at dæmpe eller aktivere tusindvis af gener parallelt, hvilket danner en slags Rosetta-sten til at omsætte genetiske forstyrrelser til biologiske ændringer. Dette er især vigtigt for at forstå genetiske interaktioner, såsom dem i kræft eller aldring, som vi ikke tidligere var fortrolige med, og for at få ny ammunition til udvikling af lægemidler.
Men en kronende præstation for CRISPR var multipleksed redigering. Ligesom at trykke på flere klavertangenter samtidigt, retter denne type genteknologi sig mod flere specifikke DNA-områder og ændrer hurtigt et genoms genetiske sammensætning på én gang.
Teknologien virker i planter og dyr. I evigheder har folk møjsommeligt avlet afgrøder med ønskværdige egenskaber – det være sig farve, størrelse, smag, ernæring eller modstandsdygtighed over for sygdomme. CRISPR kan hjælpe med at udvælge flere egenskaber eller endda tæmme nye afgrøder på kun én generation. CRISPR-genererede hornløse tyre, næringsrige tomaterog hypermuskulære husdyr og fisk allerede er virkelighed. Med verdens befolkning rammer 8 milliarder i 2022 , millioner lider af sult, CRISPRed-afgrøder kan give en livline - det vil sige, hvis folk er villige til at acceptere teknologien.
Stien frem
Hvor går vi hen herfra?
For forfatterne er vi nødt til yderligere at booste CRISPRs effektivitet og opbygge tillid. Det betyder at gå tilbage til det grundlæggende for at øge værktøjets redigeringsnøjagtighed og præcision. Her er platforme til hurtigt at udvikle Cas-enzymer, "sakse"-komponenten i CRISPR-maskineriet, kritiske.
Der har allerede været succeser: en Cas-version, for eksempel, fungerer som et rækværk for målretningskomponenten - sgRNA-"blodhunden". I klassisk CRISPR fungerer sgRNA'et alene, men i denne opdaterede version kæmper det med at binde uden Cas-assistance. Dette trick hjælper med at skræddersy redigeringen til et specifikt DNA-sted og øger nøjagtigheden, så klipningen fungerer som forudsagt.
Lignende strategier kan også øge præcisionen med færre bivirkninger eller indsætte nye gener i celler såsom neuroner og andre, der ikke længere deler sig. Selvom det allerede er muligt med prime-redigering, kan dens effektivitet være 30 gange lavere end klassiske CRISPR-mekanismer.
"Et hovedmål for prime-redigering i det næste årti er at forbedre effektiviteten uden at gå på kompromis med redigeringsproduktets renhed - et resultat, der har potentialet til at gøre prime-redigering til et af de mest alsidige værktøjer til præcisionsredigering," sagde forfatterne.
Men måske vigtigere er levering, som fortsat er en flaskehals, især for terapeutika. I øjeblikket bruges CRISPR generelt på celler uden for kroppen, der infunderes tilbage - som i tilfældet med CAR-T - eller i nogle tilfælde bundet til en viral bærer eller indkapslet i fedtbobler og sprøjtet ind i kroppen. Der har været succeser: i 2021, godkendte FDA første CRISPR-baserede skud at tackle en genetisk blodsygdom, transthyretin amyloidose.
Alligevel er begge strategier problematiske: ikke mange typer celler kan overleve CAR-T-behandlingen - dør, når de genindføres i kroppen - og målretning mod specifikke væv og organer forbliver for det meste uden for rækkevidde for injicerbare terapier.
Et vigtigt fremskridt for det næste årti, sagde forfatterne, er at skubbe CRISPR-lasten ind i det målrettede væv uden skade og frigive geneditoren på det tilsigtede sted. Hvert af disse trin, selvom de tilsyneladende er enkle på papiret, præsenterer sit eget sæt af udfordringer, som vil kræve både bioteknologi og innovation at overvinde.
Endelig kan CRISPR synergi med andre teknologiske fremskridt, sagde forfatterne. For eksempel, ved at udnytte cellebilleddannelse og maskinlæring, kunne vi snart udvikle endnu mere effektive genom-editorer. Tak til hurtigere og billigere DNA-sekventering, kan vi så nemt overvåge konsekvenserne af genredigering. Disse data kan så give en slags feedback-mekanisme til at konstruere endnu mere kraftfulde genom-editorer i en virtuous loop.
Virkelighed i verden
Selvom yderligere udvidelse af CRISPR-værktøjskassen er på dagsordenen, er teknologien tilstrækkelig moden til at påvirke den virkelige verden i dets andet årti, sagde forfatterne.
I den nærmeste fremtid bør vi se "et øget antal CRISPR-baserede behandlinger flytte til senere stadier af kliniske forsøg." Ser man længere frem, kan teknologien eller dens varianter gøre gris-til-menneske organ xenotransplantationer rutine, snarere end eksperimentelle. Storskala screeninger for gener, der fører til ældning eller degenerative hjerne- eller hjertesygdomme - vores bedste dræbere i dag - kunne give profylaktiske CRISPR-baserede behandlinger. Det er ikke nogen let opgave: Vi har brug for både viden om den genetik, der ligger til grund for mangefacetterede genetiske sygdomme – det vil sige når flere gener kommer i spil – og en måde at levere redigeringsværktøjerne til deres mål. "Men de potentielle fordele kan drive innovation på disse områder langt ud over, hvad der er muligt i dag," sagde forfatterne.
Men med større magt følger større ansvar. CRISPR er gået frem med rasende hastighed, og regulatoriske agenturer og offentligheden kæmper stadig for at indhente det. Det måske mest berygtede eksempel var det CRISPR babyer, hvor forsøg udført mod globale etiske retningslinjer fremdrevet et internationalt konsortium, der skal lægge en rød linje for menneskelig kimcelle-redigering.
På samme måde forbliver genetisk modificerede organismer (GMO'er) et kontroversielt emne. Selvom CRISPR er langt mere præcist end tidligere genetiske værktøjer, er det op til forbrugerne at beslutte, om de vil byde velkommen en ny generation af menneskeskabte fødevarer- både planter og dyr.
Disse er vigtige samtaler, der har brug for global diskurs da CRISPR går ind i sit andet årti. Men for forfatterne ser fremtiden lys ud.
"Ligesom under fremkomsten af CRISPR-genomredigering vil en kombination af videnskabelig nysgerrighed og ønsket om at gavne samfundet drive det næste årti med innovation inden for CRISPR-teknologi," sagde de. "Ved at fortsætte med at udforske den naturlige verden, vil vi opdage, hvad der ikke kan forestilles, og sætte det til brug i den virkelige verden til gavn for planeten."
Billede Credit: NIH
- SEO Powered Content & PR Distribution. Bliv forstærket i dag.
- Platoblokkæde. Web3 Metaverse Intelligence. Viden forstærket. Adgang her.
- Kilde: https://singularityhub.com/2023/01/25/crisprs-wild-first-decade-only-scratches-the-surface-of-its-potential/
- 2020
- a
- evne
- accelereret
- Acceptere
- nøjagtighed
- præstation
- handlinger
- Yderligere
- fremme
- fremskreden
- fremskridt
- advent
- mod
- agenturer
- dagsorden
- Aging
- Landbrug
- forude
- målsætninger
- lindre
- alene
- allerede
- Skønt
- Alzheimers
- ammunition
- ,
- dyr
- dyr
- godkendt
- områder
- Assistance
- forfattere
- tilbage
- bund
- Grundlæggende
- gavner det dig
- fordele
- Berkeley
- Beyond
- Big
- Big data
- Billion
- binde
- blod
- Bloomberg
- krop
- boost
- Hjulpet
- Brain
- bringe
- bygge
- opbyg tillid
- Kræft
- kan ikke
- tilfælde
- tilfælde
- brydning
- Celler
- udfordringer
- odds
- Ændringer
- skiftende
- billigere
- Classic
- Klinisk
- kliniske forsøg
- kode
- farve
- kombination
- Kom
- sammenlignet
- komponent
- omfattende
- at gå på kompromis
- Konsekvenser
- konsortium
- Forbrugere
- fortsættende
- kontroversielle
- samtaler
- kunne
- kredit
- CRISPR
- kritisk
- afgrøder
- nysgerrighed
- For øjeblikket
- Klip
- skære
- data
- årti
- Forsvar
- levere
- levering
- udvikling
- Udvikling
- opdage
- Sygdom
- sygdomme
- dna
- ned
- snesevis
- drøm
- køre
- medicin
- i løbet af
- hver
- Tidligt
- nemt
- editor
- effektivitet
- effekter
- effektivitet
- effektiv
- indkapslet
- ingeniør
- Engineering
- Går ind i
- især
- etableret
- oprettelse
- etisk
- Endog
- udvikle sig
- eksempel
- ekspanderende
- udforske
- BERØMMELSE
- gård
- FAST
- fda
- tilbagemeldinger
- kæmpe
- Fornavn
- Fleksibilitet
- fokuserede
- fødevarer
- formular
- fra
- fuld
- yderligere
- fremtiden
- vinder
- generelt
- generere
- generation
- genteknologi
- Genetik
- Global
- Go
- mål
- gå
- eksamen
- større
- retningslinjer
- Overskrifter
- sundhedspleje
- Hjerte
- hjælpe
- hjælper
- link.
- Høj
- Fremhæv
- HTTPS
- menneskelig
- Imaging
- KIMOs Succeshistorier
- vigtigt
- forbedring
- in
- Herunder
- Forøg
- øget
- Stigninger
- utrolige
- Innovation
- interaktioner
- internationalt
- IT
- Jennifer
- bare en
- Nøgle
- nøgler
- dræbere
- Venlig
- viden
- storstilet
- føre
- læring
- låne
- brev
- Livet
- Line (linje)
- længere
- leder
- UDSEENDE
- maskine
- machine learning
- maskiner
- Main
- lave
- makeup
- mange
- modne
- midler
- mekanisme
- metoder
- millioner
- modeller
- modificeret
- Overvåg
- Måned
- mere
- mere effektiv
- mest
- flytning
- mangefacetteret
- flere
- Natural
- Natur
- I nærheden af
- Behov
- Neuroner
- Ny
- næste
- NHS
- NIH
- Nobel pris
- berygtet
- nummer
- ONE
- original
- Andet
- Andre
- uden for
- Overvind
- egen
- Papir
- Parallel
- forbi
- sti
- land
- Mennesker
- måske
- planet
- Planter
- Platforme
- plato
- Platon Data Intelligence
- PlatoData
- Masser
- befolkning
- mulig
- potentiale
- potentielt
- magt
- vigtigste
- Praktisk
- Precision
- forudsige
- forudsagde
- gaver
- tidligere
- tidligere
- Prime
- præmie
- problemer
- Produkt
- give
- offentlige
- sætte
- hurtigt
- nå
- når
- ægte
- virkelige verden
- Reality
- nylige
- Rød
- lovgivningsmæssige
- frigive
- forblive
- resterne
- kræver
- forskning
- forskere
- modstandskraft
- ansvar
- Rich
- køreplan
- roller
- Said
- Videnskab
- Scout
- screening
- skærme
- Anden
- sæt
- mangel
- bør
- side
- Silence
- Simpelt
- samtidigt
- siden
- enkelt
- websted
- Størrelse
- langsomt
- So
- Samfund
- nogle
- specifikke
- hastighed
- Spot
- spundet
- etaper
- Steps
- Stadig
- STONE
- strategier
- kampe
- Kæmper
- studerende
- sådan
- lidelse
- overflade
- overlever
- mål
- målrettet
- rettet mod
- mål
- Opgaver
- teknologisk
- Teknologier
- Grundlæggende
- verdenen
- deres
- terapi
- tusinder
- tid
- gange
- til
- i dag
- sammen
- Værktøjskasse
- værktøjer
- top
- emne
- Tårn
- forsøg
- Stol
- TUR
- typer
- UN
- underliggende
- forståelse
- opdateret
- brug
- forskellige
- alsidige
- udgave
- velkommen
- Hvad
- Hvad er
- hvorvidt
- som
- mens
- WHO
- Wild
- vilje
- villig
- uden
- Vandt
- Arbejde
- virker
- world
- år
- år
- Udbytte
- zephyrnet