
Evnen til at fusionere elektronik og optiske sensorer med den menneskelige krop på enkeltcelleniveau kunne en dag muliggøre fjernovervågning og -styring af individuelle celler i realtid. Fremskridt inden for elektronikfremstilling har gjort det muligt at skabe transistorer og sensorer med opløsning i nanoskala, mens innovative nanomønsterteknikker muliggør samling af disse enheder på fleksible substrater. Sådanne processer kræver dog generelt skrappe kemikalier, høje temperaturer eller vakuumteknikker, som er uegnede til levende celler og væv.
For at overvinde disse forhindringer har et forskerhold ved Johns Hopkins University udviklet en ikke-toksisk, høj opløsning og omkostningseffektiv proces til at printe guld nanomønstre på levende væv og celler. Rapportere deres resultater i Nano Letters, demonstrerer de, at den nye teknik kan "tatovere" levende celler og væv med fleksible arrays af guld nanodots og nanotråde. I sidste ende kunne metoden bruges til at integrere smarte enheder med levende væv til applikationer som bionik og biosensing.
"Hvis vi havde teknologier til at spore isolerede cellers helbred, kunne vi måske diagnosticere og behandle sygdomme meget tidligere og ikke vente, indtil hele organet er beskadiget," forklarer teamlederen David Gracias i en pressemeddelelse. "Vi taler om at sætte noget som en elektronisk tatovering på en levende genstand, der er titusinder mindre end hovedet af en nål. Det er det første skridt mod at fastgøre sensorer og elektronik på levende celler."
Tak, Luo Gu og kolleger har designet en tre-trins nanotransfer printproces til at binde guld nanomønstre til levende celler. I det første trin brugte de konventionel nanoimprint litografi (NIL) til at printe arrays af guld nanodots eller nanotråde på polymer-coatede silicium wafers. De opløste derefter polymeren og frigjorde nanoarrays til overførsel på glasdækglas.
Dernæst funktionaliserede forskerne guldoverfladen med cysteamin og coated guld-NIL-arrays med et alginat-hydrogel-overførselslag. De viste, at denne tilgang pålideligt kunne overføre 8 × 8 mm arrays af nanodots og nanotråde fra glasset til de bløde og fleksible hydrogeler. I det sidste trin konjugeres guld-NIL-arrays med gelatine for at muliggøre deres overførsel til levende celler eller væv. Dissociering af hydrogeloverførselslaget afslører derefter guldmønsteret.
Forskerne undersøgte adfærden af levende fibroblastceller podet på arrays af 250 nm-diameter guldprikker (550 nm center-til-center afstand) eller 300 nm brede guldtråde (450 nm afstand) på alginathydrogeler. Omkring 24 timer efter podning migrerede celler på den nanotråd-printede hydrogel fortrinsvis parallelt med nanotrådene, hvorimod dem på nanodotter udviste tilfældig, men lidt hurtigere, migration. Celler på nanotrådene udviste også omtrent det dobbelte af forlængelsen af dem på nanodotterne. Disse resultater demonstrerer evnen af guld NIL-arrays til at guide celleorientering og migration.
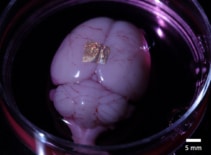
Ud over at være biokompatibel med celler og væv, kan alginathydrogel også overføre guld NIL-arrays til levende organer og celler. For at demonstrere dette placerede forskerne nanotrådstrykte hydrogeler på hjernebarken i en hel hjerne og en koronal hjerneskive.
Efter 2 timer i kulturmedier og dissociering af hydrogelen forblev nanotrådene bundet til overfladen af hele hjernen. I modsætning hertil klæbede nanotråde på hjerneskiven ikke, hvilket tyder på, at adhæsionsstyrken varierer mellem forskellige celletyper og dyrkningsmetoder. Forskerne bemærker, at yderligere undersøgelser er nødvendige for at karakterisere og optimere adhæsionsmekanismer til robust langtidsbinding.
Endelig, for at vurdere biotransferudskrivning på enkeltcelleniveau, dyrkede forskerne monolagcelleark på guld NIL-array-printede alginathydrogeler. Efter 24 timer vendte de de fibroblastfrøede hydrogeler over på gelatinebelagte dækglas og lod cellerne binde sig til dækglasset natten over.
Efter dissociering af alginathydrogelen afslørede fluorescensmikroskopi, at fibroblaster mønstret med guldnanodotter havde en levedygtighed på cirka 97 %, mens dem med mønstre med nanotråde havde en levedygtighed på cirka 98 %, hvilket indikerer, at udskrivningsprocessen er biokompatibel med levende celler. Reflekterende farver set på det mønstrede fibroblastcelleark antyder, at formen af guld-NIL-arrayet blev bibeholdt.
Fremstillingsprocessen er også kompatibel med mikroskala fotolitografi, som gjorde det muligt for forskerne at skabe 200 µm brede sekskantede og trekantede pletter af guld NIL-arrays. De biotransfer printede derefter disse på celleark, hvilket førte til selektiv vækst af fibroblastceller på mikroplastrene. Film optaget over 16 timer viste, at celler med pletter af nanotråde printet ovenpå virkede sunde og i stand til at migrere, hvor arrays forblev på de bløde celler, selv mens de bevægede sig.

Lille sensor måler samtidig elektrisk og mekanisk aktivitet i hjerteceller
"Vi har vist, at vi kan knytte komplekse nanomønstre til levende celler, samtidig med at vi sikrer, at cellen ikke dør," siger Gracias. "Det er et meget vigtigt resultat, at cellerne kan leve og bevæge sig med tatoveringerne, fordi der ofte er en betydelig inkompatibilitet mellem levende celler og de metoder, ingeniører bruger til at fremstille elektronik."
Gracias og kolleger konkluderer, at deres nanomønsterproces, kombineret med standard mikrofremstillingsteknikker, "åbner muligheder for udvikling af nye cellekultursubstrater, biohybride materialer, bioniske enheder og biosensorer". Dernæst planlægger de at forsøge at fastgøre mere komplekse nanokredsløb, der kan blive på plads i længere perioder, samt at eksperimentere med forskellige typer celler.
- SEO Powered Content & PR Distribution. Bliv forstærket i dag.
- PlatoData.Network Vertical Generative Ai. Styrk dig selv. Adgang her.
- PlatoAiStream. Web3 intelligens. Viden forstærket. Adgang her.
- PlatoESG. Automotive/elbiler, Kulstof, CleanTech, Energi, Miljø, Solenergi, Affaldshåndtering. Adgang her.
- PlatoHealth. Bioteknologiske og kliniske forsøgs intelligens. Adgang her.
- ChartPrime. Løft dit handelsspil med ChartPrime. Adgang her.
- BlockOffsets. Modernisering af miljømæssig offset-ejerskab. Adgang her.
- Kilde: https://physicsworld.com/a/researchers-tattoo-gold-nanopatterns-onto-live-cells/
- :har
- :er
- :ikke
- $OP
- 16
- 200
- 24
- 8
- a
- evne
- I stand
- Om
- aktivitet
- klæbe
- fremskridt
- Efter
- også
- blandt
- an
- ,
- dukkede
- applikationer
- tilgang
- cirka
- ER
- omkring
- Array
- AS
- Assembly
- vurdere
- At
- vedhæfte
- BE
- fordi
- være
- mellem
- krop
- obligation
- Brain
- men
- CAN
- Celler
- karakterisere
- klik
- kolleger
- kombineret
- kompatibel
- komplekse
- konkluderer
- kontrast
- kontrol
- konventionelle
- omkostningseffektiv
- kunne
- skabe
- Medarbejder kultur
- dag
- demonstrere
- konstrueret
- udviklet
- Udvikling
- Enheder
- DID
- Die
- forskellige
- sygdomme
- Er ikke
- tidligere
- elektronisk
- Elektronik
- muliggøre
- aktiveret
- Ingeniører
- sikring
- Hele
- Endog
- Forklarer
- hurtigere
- endelige
- fund
- Fornavn
- fleksibel
- Til
- fra
- yderligere
- GAO
- generelt
- glas
- Guld
- Vækst
- vejlede
- havde
- Have
- hoved
- Helse
- sund
- Hjerte
- Høj
- høj opløsning
- hopkins
- Men
- HTTPS
- menneskelig
- billede
- vigtigt
- in
- individuel
- oplysninger
- innovativ
- integrere
- isolerede
- spørgsmål
- IT
- johns
- Johns Hopkins University
- jpg
- lag
- leder
- førende
- lad
- Niveau
- ligesom
- leve
- levende
- langsigtet
- længere
- lavet
- materialer
- max-bredde
- kan være
- foranstaltninger
- mekanisk
- mekanismer
- Medier
- Flet
- metode
- metoder
- Mikroskopi
- migrere
- migreret
- migration
- overvågning
- mere
- bevæge sig
- flyttet
- Film
- meget
- behov
- Ny
- næste
- objekt
- forhindringer
- of
- tit
- on
- ONE
- på
- åbent
- Muligheder
- Optimer
- or
- i løbet af
- Overvind
- overnight
- Parallel
- Patches
- Mønster
- perioder
- Fysik
- Fysik verden
- Place
- fly
- plato
- Platon Data Intelligence
- PlatoData
- positionerede
- mulig
- trykke
- trykning
- behandle
- Processer
- Sætte
- tilfældig
- ROTTE
- ægte
- realtid
- registreres
- forblevet
- resterende
- fjern
- Rapportering
- kræver
- forskning
- forskere
- Løsning
- resultere
- Revealed
- robust
- groft
- siger
- set
- selektiv
- sensorer
- Shape
- ark
- viste
- vist
- signifikant
- Silicon
- samtidigt
- Slice
- mindre
- Smart
- Soft
- noget
- standard
- Statement
- forblive
- Trin
- styrke
- undersøgelser
- sådan
- tyder
- overflade
- taler
- hold
- teknikker
- Teknologier
- tiere
- end
- at
- deres
- derefter
- Disse
- de
- denne
- dem
- thumbnail
- tid
- gange
- til
- top
- mod
- spor
- overførsel
- behandle
- sand
- prøv
- To gange
- typer
- Ultimativt
- universitet
- indtil
- brug
- anvendte
- Vacuum
- meget
- levedygtighed
- vente
- var
- we
- GODT
- ud fra følgende betragtninger
- som
- mens
- Hele
- bred
- med
- world
- zephyrnet












