Cellerne i alle levende organismer drives af det samme kemiske brændstof: adenosintriphosphat (ATP). Nu har forskere fundet en måde at generere ATP direkte fra elektricitet, hvilket kan sætte gang i bioteknologiske processer, der dyrker alt fra mad til brændstof til lægemidler.
Det er notorisk svært at forbinde moderne elektronikbaseret teknologi med biologi. En stor anstødssten er, at den måde, de drives på, er meget forskellig. Mens de fleste af vores gadgets kører på elektroner, er naturen afhængig af den energi, der frigives, når de kemiske bindinger af ATP brydes. At finde måder at konvertere mellem disse to meget forskellige energivalutaer kunne være nyttigt for en lang række bioteknologier.
Genetisk manipulerede mikrober bliver allerede brugt til at producere forskellige højværdikemikalier og terapeutisk nyttige proteiner, og der er håb om, at de snart kan hjælpe med at skabe grønnere jetbrændstof, nedbryde plastikaffald og endda dyrke nye fødevarer i gigantiske bioreaktorer. Men i øjeblikket drives disse processer gennem en ineffektiv proces med at dyrke biomasse, omdanne den til sukker og fodre den til mikroberne.
Nu har forskere ved Max Planck Institute for Terrestrial Microbiology i Tyskland udtænkt en meget mere direkte måde at drive biologiske processer på. De har skabt en kunstig metabolisk vej, der direkte kan omdanne elektricitet til ATP ved hjælp af en cocktail af enzymer. Og afgørende er, at processen fungerer vitro og er ikke afhængig af cellernes indfødte maskineri.
"At tilføre elektricitet direkte til kemiske og biokemiske reaktioner er et reelt gennembrud,” Tobias Erb, der ledede forskningen, sagde i en pressemeddelelse. "Dette vil muliggøre syntese af energirige værdifulde ressourcer såsom stivelse, biobrændstoffer eller proteiner fra simple cellulære byggesten - i fremtiden endda fra kuldioxid. Det kan endda være muligt at bruge biologiske molekyler til at lagre elektrisk energi."
I naturen kan ATP og dets søstermolekyle adenosindifosfat (ADP) opfattes som næsten som batterier. ATP er som et opladet batteri, der lagrer energi i dets kemiske bindinger. Hvis en celle skal bruge den energi, brækker den en af of molekylets tre fosfatgrupper og energien bundet i den kemiske binding kan så drive en eller anden cellulær proces.
Denne proces omdanner ATP-molekylet til ADP, som kan opfattes som et tomt batteri. For at genoplade den skal cellen bruge energi fra mad eller fotosyntese for at tilføje en fosfatgruppe tilbage til ADP-molekylet, hvilket gør det tilbage til ATP.
Men denne genopladningsproces er afhængig af en kompleks sekvens af reaktioner, der involverer forskellige proteinkomplekser indlejret i cellemembranen. At omkonstruere dette system til at fungere uden for en celle er udfordrende, fordi det kræver, at de forskellige proteiner omhyggeligt orienteres i en kunstig membran, hvilket gør det både kræsent og skrøbeligt.
Den nye tilgang, skitseret i en papir ind Joule, er meget enklere. Kaldt "AAA-cyklussen" involverer det kun fire enzymer, der interagerer i en opløsning. Nøgleingrediensen, der gjorde det hele muligt, var opdagelsen af et enzym kaldet aldehyd ferredoxin oxidoreductase (AOR) i en nyligt opdaget bakterie kaldet Aromaticum aromatoleum, som er i stand til at nedbryde petroleum.
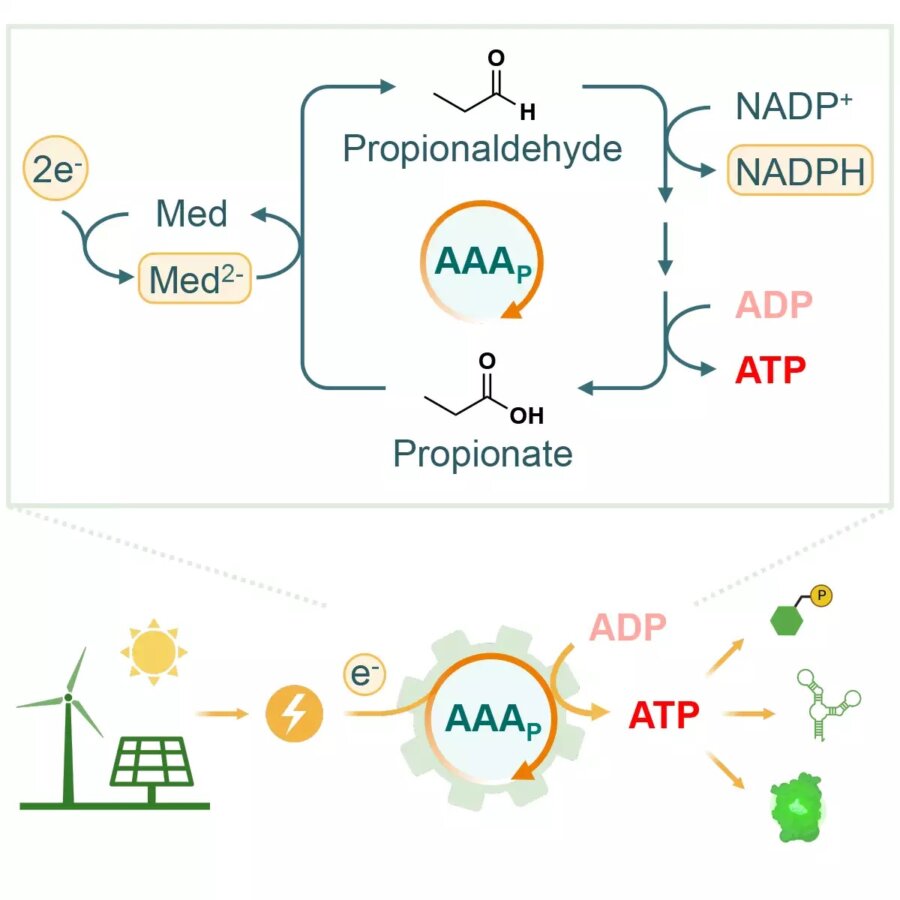
Dette enzym er i stand til at tage elektronerne fra en elektrode og binde deres energi i en aldehydbinding, der tilsættes til et prækursorkemikalie kaldet propionat. Dette kaskades derefter gennem yderligere tre enzymer, der virker på kemikaliet og i sidste ende bruger den energi, der er lagret i det, til at omdanne ADP til ATP. I slutningen popper et propionatmolekyle ud, som derefter kan føres tilbage i kredsløbet.
"Den simple AAA-cyklus er en smart og elegant tilgang...det er meget enklere end hvordan biologi naturligt gør ATP,« Drew Endy, en syntetisk biolog ved Stanford University, fortalt Videnskab. Han tilføjede, at det kunne være en nøglemulighed for at gøre "elektrobiosyntese" mulig, ideen om at bruge elektricitet til direkte at drive syntesen af nyttige kemikalier af celler.
Forskerne siger, at processen stadig kræver arbejde, da enzymerne er ustabile og kun i stand til at omdanne en lille mængde energi. Men hvis ideen kan raffineres og opskaleres, kan den gøre det muligt at køre alle mulige kraftfulde bioteknologiske processer på vedvarende energi, ikke kun gøre dem grønnere, men også udvide betydeligt.ING mængden af energi, de kan udnytte.
Billede Credit: günther / Pixabay
- SEO Powered Content & PR Distribution. Bliv forstærket i dag.
- PlatoData.Network Vertical Generative Ai. Styrk dig selv. Adgang her.
- PlatoAiStream. Web3 intelligens. Viden forstærket. Adgang her.
- PlatoESG. Automotive/elbiler, Kulstof, CleanTech, Energi, Miljø, Solenergi, Affaldshåndtering. Adgang her.
- PlatoHealth. Bioteknologiske og kliniske forsøgs intelligens. Adgang her.
- ChartPrime. Løft dit handelsspil med ChartPrime. Adgang her.
- BlockOffsets. Modernisering af miljømæssig offset-ejerskab. Adgang her.
- Kilde: https://singularityhub.com/2023/08/31/in-a-new-biology-electronics-crossover-scientists-used-electricity-to-produce-the-chemical-fuel-of-cells/
- :er
- :ikke
- $OP
- 23
- a
- AAA
- I stand
- Lov
- tilføje
- tilføjet
- ADP
- Alle
- næsten
- allerede
- beløb
- an
- ,
- tilgang
- ER
- kunstig
- AS
- At
- tilbage
- batterier
- batteri
- BE
- fordi
- være
- mellem
- binde
- biologi
- bioteknologi
- Bloker
- obligation
- Obligationer
- både
- Bound
- Pause
- pauser
- gennembrud
- Broken
- Bygning
- men
- by
- kaldet
- CAN
- kulstof
- carbondioxid
- omhyggeligt
- Celler
- udfordrende
- opladet
- kemikalie
- cocktail
- komplekse
- konvertere
- konvertering af
- kunne
- oprettet
- kredit
- afgørende
- valutaer
- Nuværende
- cyklus
- forskellige
- svært
- direkte
- direkte
- opdagelse
- Er ikke
- ned
- døbt
- elektricitet
- elektroner
- indlejret
- muliggøre
- muliggør
- ende
- energi
- Endog
- at alt
- Fed
- fodring
- finde
- mad
- fødevarer
- Til
- fundet
- fire
- fra
- Brændstof
- fremtiden
- Gadgets
- generere
- Tyskland
- kæmpe
- gruppe
- Gruppens
- Grow
- Dyrkning
- Have
- he
- hjælpe
- Høj
- håber
- host
- Hvordan
- HTTPS
- idé
- if
- in
- ineffektiv
- Institut
- interaktion
- ind
- involverer
- IT
- ITS
- jpg
- lige
- Nøgle
- Led
- til venstre
- ligesom
- levende
- maskiner
- lavet
- større
- lave
- maerker
- Making
- max
- max-bredde
- Kan..
- minut
- Moderne
- molekyle
- mere
- mest
- meget
- indfødte
- Natur
- behov
- Ny
- nu
- of
- off
- on
- ONE
- kun
- på
- or
- vores
- ud
- skitseret
- uden for
- pathway
- Petroleum
- lægemidler
- Fotosyntese
- plast
- plato
- Platon Data Intelligence
- PlatoData
- Pops
- mulig
- magt
- strøm
- vigtigste
- forløber
- trykke
- behandle
- Processer
- producere
- Protein
- Proteiner
- reaktioner
- ægte
- raffinerede
- frigivet
- stole
- Vedvarende
- vedvarende energi
- Kræver
- forskning
- forskere
- Ressourcer
- Kør
- samme
- siger
- Videnskab
- forskere
- Sequence
- betydeligt
- Simpelt
- enklere
- søster
- lille
- løsninger
- nogle
- snart
- tilbringe
- Stanford
- Stanford University
- Stadig
- butik
- opbevaret
- lagring
- snublende
- sådan
- sukker
- syntetisk
- systemet
- Tag
- Tryk på
- Teknologier
- jordbaserede
- end
- at
- Fremtiden
- deres
- Them
- derefter
- Der.
- Disse
- de
- denne
- tænkte
- tre
- Gennem
- til
- Drejning
- to
- Ultimativt
- universitet
- brug
- anvendte
- ved brug af
- Værdifuld
- forskellige
- meget
- var
- Affald
- Vej..
- måder
- hvornår
- som
- mens
- WHO
- vilje
- med
- Arbejde
- virker
- zephyrnet












