Triple-negativ brystkræft (TNBC) er en aggressiv undertype, der er forbundet med tidligt metastatisk tilbagefald og dårligere patientforløb. Tumoren udtrykker molekylære markører for den epiteliale-mesenchymale overgang, men dens behov under spontan TNBC-metastase in vivo forbliver ufuldstændigt forstået.
Forskere fra Johns Hopkins Medicine har identificeret betydelige molekylære variationer mellem kræftceller, der klæber sig til en initial tumor, og dem, der spreder sig for at danne fjerne tumorer.
Andrew Ewald, Ph.D., Virginia DeAcetis professor i grundvidenskabelig forskning og direktør, afdeling for cellebiologi ved Johns Hopkins University School of Medicine, sagde: "Vi har længe haft brug for nye behandlingsmål og muligheder for triple-negative bryster kræft. Disse kræftformer vender ofte tilbage inden for tre år efter diagnosen, og behandlinger, der bruges til andre brystkræftformer, virker typisk ikke for triple-negative."
Forskere udførte undersøgelsen på musemodeller og menneskeligt væv. Denne form for kræft er særligt dødelig, fordi den mangler molekylære signaler på overfladen, der forbinder med hormonerne progesteron og østrogen, samt det kræftfremmende protein Her2-neu. Mest brystcancer behandlinger i dag retter sig mod disse markører, hvilket gør dem ineffektive for dem med triple-negative tumorer.
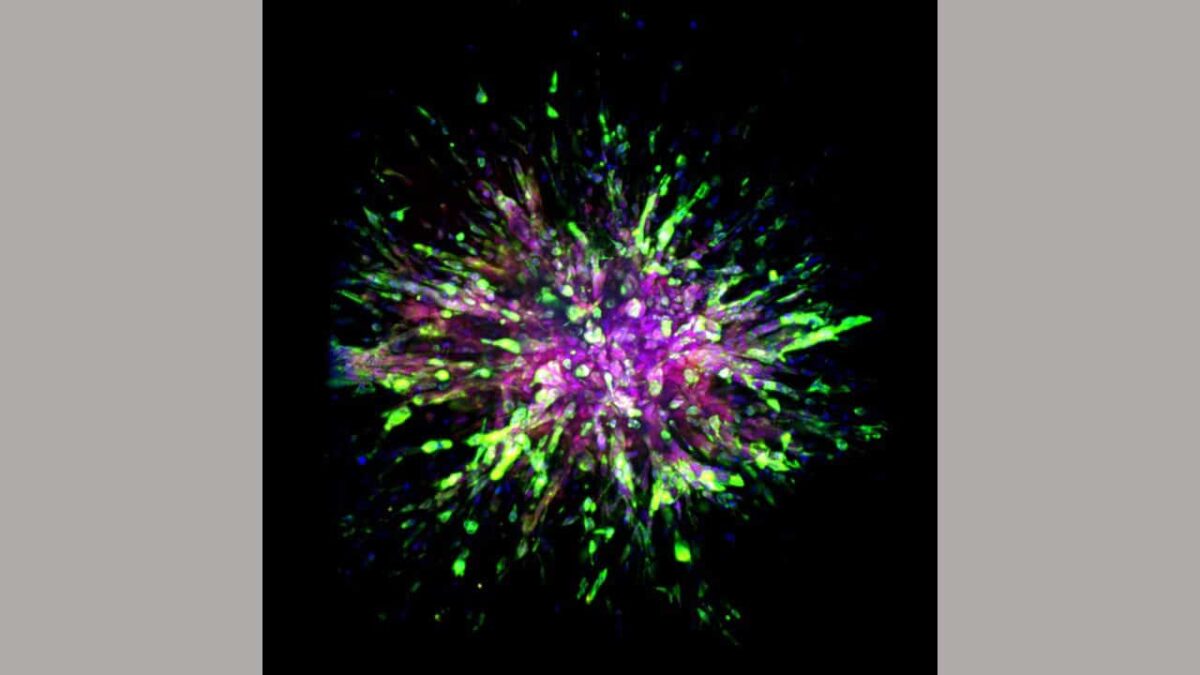
Forskere observerede i denne undersøgelse omhyggeligt molekylære forskelle mellem initiale eller primære, triple-negative brystkræftsteder og områder, hvor den spredte sig, eller metastatiske steder, blandt tre forskellige typer celler: musemodeller, humane kræftformer implanteret i mus og prøver af både primært og metastatisk væv taget fra otte patienter.
Brug af teknikker som f.eks machine learning, cellulær billeddannelse og biokemisk analyse, identificerede forskere forskelle mellem de primære og metastatiske kræftformers genomiske ekspressionsmønstre.
Ewald sagde: "Den dårlige nyhed fra vores undersøgelse er, at celler fra metastatiske steder er superoptimerede til migration og modstandsbehandling. Den gode nyhed er, at vi identificerede adskillige proteiner kaldet transkriptionsfaktorer, som disse celler kræver for at håndtere udfordringerne med at migrere og trives på metastatiske steder. Vi kan muligvis designe nye terapier, der er rettet mod disse transkriptionsfaktorer."
Forskere bemærkede adskillige karakteristiske egenskaber i cellerne hos mus implanteret med humane triple-negative brystkræfttumorer eller mus modificeret til at have museversionen af sygdommen. Det vigtigste er, at de fandt ud af, at invasion af tredobbelt negative brystkræftceller til andre væv i en anden del af kroppen, cellerne får to cellulære egenskaber: bedre bevægelse og overlevelse.
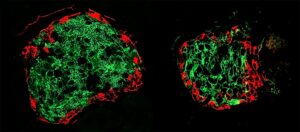
For at opnå dette erhverver brystkræftceller det vimentinske cellulære skeletprotein, som forbedrer de såkaldte mesenkymale cellers kapacitet til at migrere og generere nye celler. Mesenkymale celler er en type celle, der generelt findes i knogler og knoglemarv.
Produktionen af et protein kaldet cadherin giver overlevelsesfordele til triple-negative brystkræftceller. Proteinet findes typisk i epitelceller, der beklæder organernes kanaler og belægninger og ofte fornyer sig selv.
Forskere klassificerer deres cellulære tilstand som såkaldte hybride epitel-mesenkymale (EMT) celler, når triple-negative brystkræftceller opnår sådanne overlevelses- og migrerende egenskaber.
Med hjælp fra Elana Fertig, Ph.D., afdelingsdirektør og associeret direktør for kvantitative videnskaber og meddirektør for Convergence Institute ved Johns Hopkins Kimmel Cancer Center, observerede forskere omhyggeligt molekyler involveret i hybrid EMT-tilstande. De sporede også de molekylære mønstre af individuelle celler i celleassays, der modellerer invasion ud af den primære tumor og dannelse af en koloni på et metastatisk sted.
Forskere brugte maskinlæringsteknikker til at identificere mønstre i hver celles udtryk for RNA, en slægtning til DNA involveret i proteinsyntese. De fleste metastatiske celler, opdagede forskerne, transformerer sig til hybrid EMT-tilstanden, som er mere vandrende og mere modstandsdygtig. Derefter undersøgte forskere primære tumorer og væv fra de samme patienters metastatiske steder for at validere lignende tilstande i prøver fra otte patienter med triple-negative maligniteter.
På molekylært niveau producerer de fleste metastatiske celler fem proteiner kaldet transkriptionsfaktorer (Grhl2, Foxc2, Zeb1, Zeb2 og Ovol1), der fremmer fremstillingen af proteiner involveret i enten kræftcelleinvasion eller kolonidannelse.
Ewald sagde, "De molekylære forskelle mellem metastatiske og primære tumorer er sandsynligvis årsagen til, at metastatiske tumorceller er så modstandsdygtige over for nuværende behandlinger."
Forskere studerer nu måder at blokere transskriptionsfaktorernes gener eller deres resulterende proteiner for at standse metastatisk kræftvækst, og om de samme molekylære og cellulære ændringer sker i andre kræftformer, såsom dem i tyktarmen, binyrerne, maven og tyndtarmen.
Journal Reference:
- Eloise M. Grasset, Matthew Dunworth, et al. Triple-negativ brystkræftmetastase involverer kompleks epitel-mesenkymal overgangsdynamik og kræver vimentin. Science Translationel Medicin. DOI: 10.1126/scitranslmed.abn7571