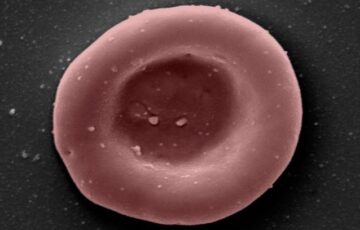
Alt liv er består af celler flere størrelser mindre end et gran salt. Deres tilsyneladende simpelt udseende strukturer maskerer den indviklede og komplekse molekylære aktivitet, der gør dem i stand til at udføre de funktioner, der opretholder livet. Forskere begynder at være i stand til at visualisere denne aktivitet til et detaljeringsniveau, de ikke har været i stand til før.
Biologiske strukturer kan visualiseres ved enten at starte på niveau med hele organismen og arbejde ned eller starte på niveau med enkelte atomer og arbejde op. Der har dog været et opløsningsgab mellem en celles mindste strukturer, såsom cytoskelettet, der understøtter cellens form, og dens største strukturer, som f.eks. ribosomer der laver proteiner i celler.
Analogt med Google Maps, mens videnskabsmænd har været i stand til at se hele byer og individuelle huse, havde de ikke værktøjerne til at se, hvordan husene kom sammen til at udgøre kvarterer. At se disse detaljer på kvarterniveau er afgørende for at kunne forstå, hvordan individuelle komponenter arbejder sammen i en celles miljø.
Nye værktøjer bygger støt bro over denne kløft. Og løbende udvikling af en bestemt teknik, kryo-elektron-tomografi eller kryo-ET, har potentialet til at uddybe, hvordan forskere studerer og forstår, hvordan celler fungerer i sundhed og sygdom.
Som den tidligere chefredaktør for Videnskab magasin og som en forsker som har studeret svære at visualisere store proteinstrukturer i årtier, har jeg været vidne til forbløffende fremskridt i udviklingen af værktøjer, der kan bestemme biologiske strukturer i detaljer. Ligesom det bliver lettere at forstå, hvordan komplicerede systemer fungerer, når man ved, hvordan de ser ud, er forståelsen af, hvordan biologiske strukturer passer sammen i en celle, nøglen til at forstå, hvordan organismer fungerer.
En kort historie om mikroskopi
I det 17. århundrede lysmikroskopi først afslørede eksistensen af celler. I det 20. århundrede tilbød elektronmikroskopi endnu flere detaljer og afslørede komplicerede strukturer i celler, herunder organeller som det endoplasmatiske reticulum, et komplekst netværk af membraner, der spiller nøgleroller i proteinsyntese og transport.
Fra 1940'erne til 1960'erne arbejdede biokemikere på at adskille celler i deres molekylære komponenter og lære, hvordan man bestemmer 3D-strukturerne af proteiner og andre makromolekyler ved eller nær atomær opløsning. Dette blev først gjort ved hjælp af røntgenkrystallografi til at visualisere strukturen af myoglobin, et protein, der leverer ilt til musklerne.
I løbet af det seneste årti er teknikker baseret på nukleær magnetisk resonans, som producerer billeder baseret på, hvordan atomer interagerer i et magnetfelt, og kryo-elektronmikroskopi har hurtigt øget antallet og kompleksiteten af de strukturer, videnskabsmænd kan visualisere.
Hvad er Cryo-EM og Cryo-ET?
Kryo-elektronmikroskopi eller kryo-EM, bruger et kamera til at detektere, hvordan en stråle af elektroner afbøjes, når elektronerne passerer gennem en prøve for at visualisere strukturer på molekylært niveau. Prøver fryses hurtigt for at beskytte dem mod strålingsskader. Detaljerede modeller af strukturen af interesse er lavet ved at tage flere billeder af individuelle molekyler og gennemsnit af dem til en 3D-struktur.
Cryo-ET deler lignende komponenter med cryo-EM, men bruger forskellige metoder. Fordi de fleste celler er for tykke til at blive afbildet klart, fortyndes et område af interesse i en celle først ved at bruge en ionstråle. Prøven vippes derefter for at tage flere billeder af den i forskellige vinkler, analogt med en CT-scanning af en kropsdel (selvom i dette tilfælde selve billeddannelsessystemet vippes i stedet for patienten). Disse billeder kombineres derefter af en computer for at producere et 3D-billede af en del af cellen.
Opløsningen af dette billede er høj nok til, at forskere (eller computerprogrammer) kan identificere de individuelle komponenter af forskellige strukturer i en celle. Forskere har brugt denne tilgang, for eksempel til at vise, hvordan proteiner bevæger sig og nedbrydes inde i en algecelle.
Mange af de trin, forskerne engang skulle gøre manuelt for at bestemme cellernes strukturer, bliver automatiserede, hvilket gør det muligt for forskere at identificere nye strukturer ved langt højere hastigheder. For eksempel at kombinere cryo-EM med kunstig intelligens programmer som AlphaFold kan lette billedfortolkning ved at forudsige proteinstrukturer, der endnu ikke er blevet karakteriseret.
Forståelse af cellestruktur og funktion
Efterhånden som billeddannelsesmetoder og arbejdsgange forbedres, vil forskere være i stand til at tackle nogle nøglespørgsmål inden for cellebiologi med forskellige strategier.
Det første skridt er at beslutte, hvilke celler og hvilke regioner i disse celler, der skal studeres. En anden visualiseringsteknik kaldet korreleret lys- og elektronmikroskopi eller CLEM, bruger fluorescerende tags til at hjælpe med at lokalisere områder, hvor interessante processer finder sted i levende celler.
Sammenligning af genetisk forskel mellem celler kan give yderligere indsigt. Forskere kan se på celler, der ikke er i stand til at udføre bestemte funktioner, og se, hvordan dette afspejles i deres struktur. Denne tilgang kan også hjælpe forskere med at studere, hvordan celler interagerer med hinanden.
Cryo-ET vil sandsynligvis forblive et specialiseret værktøj i nogen tid. Men yderligere teknologisk udvikling og øget tilgængelighed vil gøre det muligt for det videnskabelige samfund at undersøge sammenhængen mellem cellulær struktur og funktion på tidligere utilgængelige detaljeringsniveauer. Jeg forventer at se nye teorier om, hvordan vi forstår celler, der bevæger sig fra uorganiserede poser med molekyler til indviklet organiserede og dynamiske systemer.
Denne artikel er genudgivet fra The Conversation under en Creative Commons-licens. Læs oprindelige artikel.
Billede Credit: Nanografi, CC BY-SA
- SEO Powered Content & PR Distribution. Bliv forstærket i dag.
- Platoblokkæde. Web3 Metaverse Intelligence. Viden forstærket. Adgang her.
- Kilde: https://singularityhub.com/2023/01/09/visualizing-the-inside-of-cells-at-previously-impossible-resolutions-provides-vivid-insights-into-how-they-work/
- 2018
- 3d
- a
- I stand
- tilgængelighed
- aktivitet
- Yderligere
- tillade
- Skønt
- ,
- En anden
- foregribe
- tilgang
- artikel
- kunstig
- kunstig intelligens
- Automatiseret
- tasker
- baseret
- Beam
- fordi
- bliver
- blive
- før
- Begyndelse
- være
- mellem
- biologi
- krop
- brodannelse
- kaldet
- værelse
- bære
- tilfælde
- Celler
- Århundrede
- kendetegnet
- byer
- tydeligt
- KOM
- kombineret
- kombinerer
- Commons
- samfund
- komplekse
- kompleksitet
- kompliceret
- komponenter
- computer
- indhold
- Kreativ
- kredit
- årti
- årtier
- uddybe
- detail
- detaljeret
- detaljer
- Bestem
- Udvikling
- udvikling
- DID
- forskel
- forskellige
- Sygdom
- ned
- dynamisk
- hver
- lettere
- enten
- elektroner
- indlejret
- muliggør
- nok
- Hele
- Miljø
- væsentlig
- Endog
- eksempel
- lette
- felt
- Fornavn
- passer
- Tidligere
- fra
- frosset
- funktion
- funktioner
- yderligere
- kløft
- Genetik
- google maps
- større
- Helse
- hjælpe
- Høj
- højere
- historie
- huse
- Hvordan
- How To
- Men
- HTTPS
- identificere
- billede
- billeder
- Imaging
- umuligt
- Forbedre
- in
- utilgængelig
- Herunder
- øget
- stigende
- individuel
- indsigt
- indsigt
- Intelligens
- interagere
- interesse
- interessant
- fortolkning
- IT
- selv
- Nøgle
- Kend
- stor
- største
- LÆR
- Niveau
- niveauer
- Licens
- Livet
- lys
- Sandsynlig
- LINK
- levende
- Se
- ligner
- lavet
- Magnetfelt
- lave
- manuelt
- Maps
- maske
- metoder
- Mikroskopi
- modeller
- molekylær
- mest
- bevæge sig
- flytning
- flere
- I nærheden af
- netværk
- Ny
- nummer
- tilbydes
- ONE
- igangværende
- Organiseret
- Andet
- Oxygen
- del
- særlig
- forbi
- patient
- PHP
- Billeder
- Place
- plato
- Platon Data Intelligence
- PlatoData
- Leg
- potentiale
- forudsige
- tidligere
- Processer
- producere
- Programmer
- Progress
- beskytte
- Protein
- Proteiner
- give
- giver
- Spørgsmål
- hurtigt
- Læs
- afspejles
- region
- regioner
- forblive
- forskere
- Løsning
- Revealed
- afslørende
- roller
- scanne
- Videnskab
- forskere
- se
- flere
- Shape
- Aktier
- Vis
- lignende
- enkelt
- nogle
- Kilde
- specialiserede
- hastigheder
- Starter
- Trin
- Steps
- strategier
- struktur
- studeret
- Studere
- sådan
- Understøtter
- systemet
- Systemer
- Tag
- tager
- teknikker
- teknologisk
- deres
- Gennem
- tid
- til
- sammen
- også
- værktøj
- værktøjer
- transportere
- forstå
- forståelse
- visualisering
- Hvad
- som
- mens
- WHO
- vilje
- inden for
- vidne
- Arbejde
- arbejde sammen
- arbejdede
- arbejdsgange
- arbejder
- røntgen
- Du
- youtube
- zephyrnet