Bugspytkirtelkræft er en notorisk dødelig sygdom med en fem-års overlevelsesrate på omkring 9%. Da operation kun er passende for 8-20 % af patienterne, er kemoterapi den mest almindelige behandling, hvor strålebehandling stadig er sparsomt anvendt og hovedsageligt som en adjuverende mulighed.
Kliniske forsøg, der undersøger strålebehandlinger af bugspytkirtelkræft, har givet modstridende resultater, hvilket fremmer en debat om de bedste retningslinjer for anvendelse og potentielle fordele. Bugspytkirtelkræft er notorisk resistent over for kemoterapi og strålebehandling på grund af et ekstremt komplekst tumormikromiljø (TME, vævene omkring en kræftlæsion) karakteriseret ved tilstedeværelsen af forskellige cellepopulationer og stærke hypoxigradienter.
Nyere avancerede strålebehandlingsmodaliteter, såsom MR-styret strålebehandling, som anvender MR til at vejlede leveringen af stråledosen, kan give en vis fordel ved at levere nøjagtige oplysninger om TME. Dette kunne så bruges til at optimere behandlingen. Til dato er der dog begrænset viden om samspillet mellem stråling og det statiske magnetfelt fra et MR-styret strålebehandlingssystem, og hvordan dette kan påvirke kræftcellernes respons.
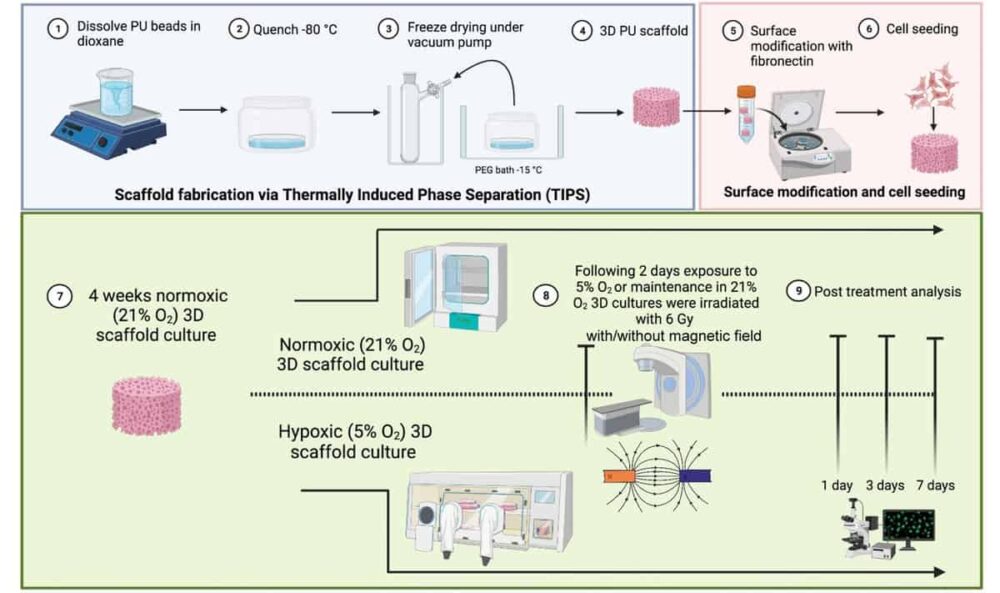
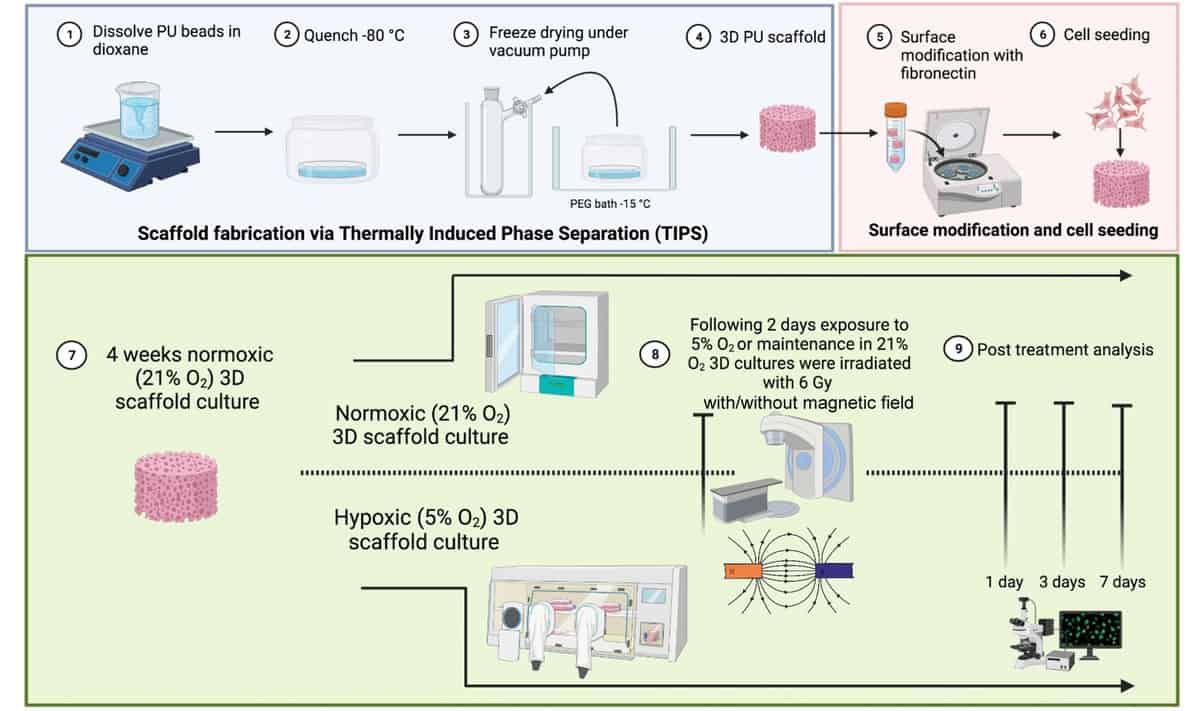
For at studere komplekse TME'er som dem, der er forbundet med kræft i bugspytkirtlen, har et britisk-baseret forskerhold udviklet en 3D polymer meget makroporøs stilladsmodel. Forskerne fra University of Surrey, University College London og National Physical Laboratory (NPL), skabte den multicellulære ikke-dyremodel til at evaluere virkningen af et statisk magnetfelt på reaktionen fra pancreascancerceller på MR-styret strålebehandling.
Pancreas duktalt adenokarcinom har en kompleks og stærkt immunsuppressiv TME, der indeholder mange forskellige celletyper, herunder pancreas stellate celler, der, når de er aktiveret af cancerceller, skaber tæt desmoplasi (overdreven bindevæv). Denne desmoplasi, sammen med kaotisk kræftcellevækst, forårsager kollaps af blodkar og dannelsen af afvigende, uorganiserede karnetværk, hindrer levering af kemoterapi og skaber store hypoxiske vidder, der forringer strålebehandlingens effektivitet.
3D-modellen, beskrevet i British Journal of Radiology, inkorporerer bugspytkirtelcancerceller, humane mikrovaskulære endotelceller og pancreas stellatceller. Den består af et ydre kollagenbelagt rum til vækst af stellat- og endotelceller og et indre fibronectin-belagt rum til vækst af kræftcellerne. Denne arkitektur understøtter vækst og spredning af forskellige TME-celler, hvilket gør det muligt for celler at migrere fra et rum til et andet i løbet af en længere observationsperiode på 37 dage. Det er vigtigt, at modellen er i stand til at replikere de hypoxiske områder af TME.
Ledende efterforsker Giuseppe Schettino og kolleger brugte deres 3D-stilladsmodel til at undersøge pancreaskræftcellers reaktion på stråling i kombination med et statisk magnetfelt. De bestrålede prøver udsat for hypoxi (1 % O2) eller normoksi (21 % O2) med 6 MV-fotoner i nærvær eller fravær af et 1.5 T-felt ved hjælp af dedikeret udstyr ved NPL. De overvågede derefter cellelevedygtighed og celleapoptose én og syv dage efter bestråling.
Resultaterne afslørede en systematisk tendens til hypoxi-associeret radiobeskyttelse i bugspytkirtelkræftceller i 3D-stilladserne, med øget tumorcellelevedygtighed og nedsat celleapoptose set i både kortsigtede og langsigtede analyser. Specifikt førte bestråling af stilladser i normoksi til et signifikant fald i levende celler, mens dem, der blev behandlet med stråling i hypoxi, ikke viste noget signifikant fald. Holdet bemærker, at dette er i overensstemmelse med tidligere resultater af radiobeskyttelse under vitro hypoxi.
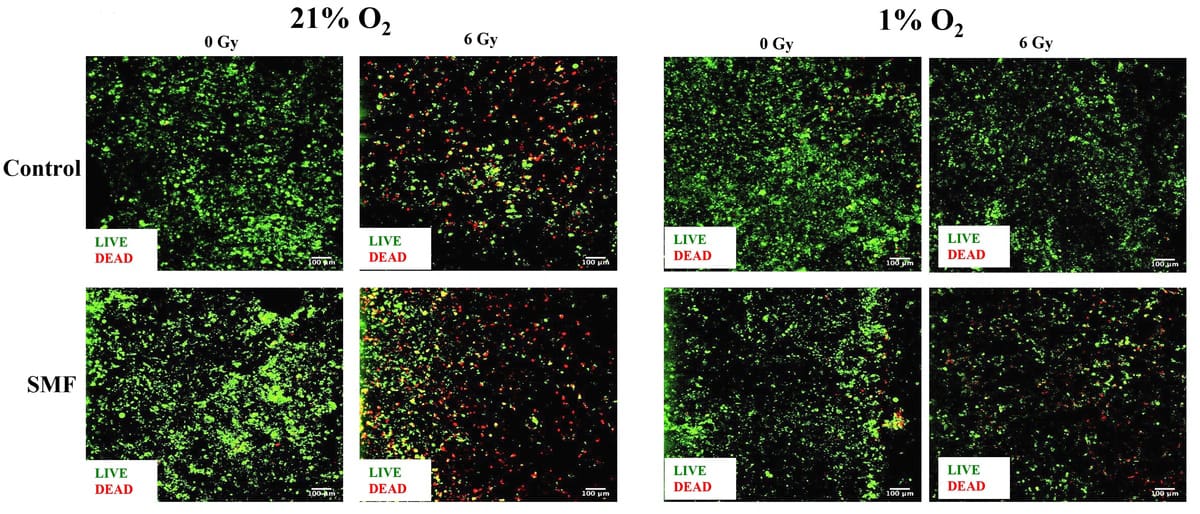
Forskerne rapporterer, at de i både hypoksi og normoksi observerede en lille forbedring af effekten af stråling i nærvær af det statiske magnetfelt. Eksponering for magnetfeltet alene inducerede ikke nogen toksicitet. De planlægger nu at undersøge de mekanismer, der er ansvarlige for en sådan strålingsforøgelse, i fremtidige undersøgelser.
"Det er vigtigt at have gode modeller til at teste nye terapeutiske tilgange til svære at behandle kræftformer, såsom billedstyret strålebehandling, som anvender stærke magnetfelter," siger Schettino. "Før man klinisk tager nye tilgange i brug, skal de evalueres godt og forstås på det prækliniske niveau, hvilket normalt kræver brug af dyremodeller, som ikke altid repræsenterer mennesker godt. Vores ikke-dyremodel kan vurdere magnetfeltets potentielle indvirkning på strålingsresponsen."
Ioniserende stråling blødgør tumormikromiljøet
"Vores arbejde er rettet mod at forbedre cancerstrålebehandling gennem en mere biologisk optimeret tilgang," fortæller han Fysik verden. "Vi er nødt til at analysere, hvordan interaktionen mellem magnetfeltet, strålingsstrålen og cellulære og molekylære processer kan ændre responsen fra både normalt og kræftvæv og derfor effekten af strålebehandlingen. Det er nyttigt at estimere en sådan effekt, eller mangel på effekt, til at designe og planlægge nye kliniske forsøg."
Schettino oplyser, at NPL er interesseret i at bruge den flercellede stilladsmodel med protonstråler og potentielt også FLASH-stråler.
- SEO Powered Content & PR Distribution. Bliv forstærket i dag.
- Platoblokkæde. Web3 Metaverse Intelligence. Viden forstærket. Adgang her.
- Kilde: https://physicsworld.com/a/3d-cancer-model-reveals-how-a-static-magnetic-field-can-enhance-radiotherapy/
- :er
- 1
- 10
- 3d
- 7
- a
- I stand
- Om
- AC
- præcis
- Vedtagelsen
- fremskreden
- Efter
- alene
- altid
- analysere
- Analyser
- ,
- dyr
- En anden
- Indløs
- tilgang
- tilgange
- passende
- arkitektur
- AS
- forbundet
- At
- BE
- Beam
- gavner det dig
- fordele
- BEDSTE
- mellem
- blod
- by
- CAN
- Kræft
- Kræftceller
- årsager
- Celler
- kendetegnet
- klik
- Klinisk
- kliniske forsøg
- CO
- Bryder sammen
- kolleger
- Kollegium
- kombination
- Fælles
- komplekse
- Modstridende
- kunne
- skabe
- oprettet
- Oprettelse af
- Dato
- dag
- Dage
- debat
- falde
- dedikeret
- levering
- beskrevet
- designe
- udviklet
- DID
- forskellige
- Sygdom
- forskelligartede
- Dont
- i løbet af
- effekt
- effektivitet
- beskæftiger
- muliggør
- udstyr
- evaluere
- evalueret
- Undersøgelse
- udsat
- Eksponering
- ekstremt
- felt
- Fields
- Blink
- Til
- formation
- fra
- fremtiden
- godt
- gradienter
- Grøn
- Vækst
- vejlede
- retningslinjer
- Have
- hjælpsom
- stærkt
- Hvordan
- Men
- HTTPS
- menneskelig
- Mennesker
- billede
- KIMOs Succeshistorier
- vigtigt
- forbedring
- in
- Herunder
- øget
- oplysninger
- interaktion
- interesseret
- undersøge
- spørgsmål
- IT
- tidsskrift
- jpg
- viden
- laboratorium
- Mangel
- stor
- Led
- Niveau
- ligesom
- Limited
- Line (linje)
- leve
- langsigtet
- Magnetfelt
- mange
- max-bredde
- migrere
- model
- modeller
- molekylær
- overvåges
- mere
- mest
- MRI
- national
- Behov
- net
- Ny
- normal
- Noter
- of
- on
- ONE
- åbent
- Optimer
- optimeret
- Option
- patienter
- periode
- Fotoner
- fysisk
- fly
- planlægning
- perron
- plato
- Platon Data Intelligence
- PlatoData
- populationer
- potentiale
- potentielt
- tilstedeværelse
- tidligere
- Processer
- produceret
- Fremme
- give
- Strålebehandling
- Sats
- Rød
- om
- regioner
- indberette
- repræsentere
- Kræver
- forskning
- forskere
- resistent
- svar
- ansvarlige
- Resultater
- Revealed
- afslører
- siger
- syv
- kort sigt
- signifikant
- lille
- nogle
- specifikt
- Stadig
- stærk
- undersøgelser
- Studere
- studere
- sådan
- leverer
- Understøtter
- Kirurgi
- Omkringliggende
- overlevelse
- systemet
- hold
- fortæller
- prøve
- at
- deres
- derfor
- Gennem
- thumbnail
- til
- behandling
- Trend
- forsøg
- sand
- typer
- Uk
- under
- forstået
- brug
- sædvanligvis
- Beholder
- levedygtighed
- GODT
- som
- mens
- med
- uden
- Arbejde
- world
- zephyrnet