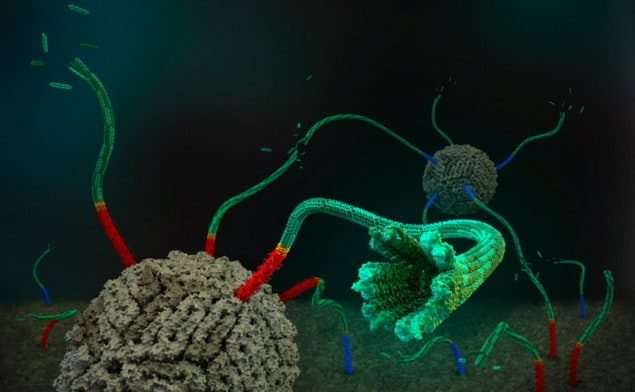
Synthetische Zellen, die so konstruiert sind, dass sie einige der Funktionen lebender Zellen nachahmen, sind vielversprechend für Anwendungen in der Biotechnologie und Medizin. Doch selbst die kleinsten biologischen Zellen sind äußerst komplex und der Bau lebender künstlicher Zellen stößt auf zahlreiche Hürden. Forscher in der Schulman Lab an der Johns Hopkins University haben kürzlich Fortschritte bei einer dieser Herausforderungen gemacht: dem Austausch von Materie und Informationen über Zellgrenzen hinweg.
Schreiben in Wissenschaft Fortschritte, die Forscher – in Zusammenarbeit mit dem Aksimentiev-Gruppe an der University of Illinois Urbana-Champaign – demonstrieren den leckagefreien Transport kleiner Moleküle durch konstruierte DNA-Nanokanäle über beispiellose Entfernungen. In Zukunft könnte ihre Arbeit bei der Konstruktion künstlicher Zellen sowie bei der Untersuchung und Manipulation lebenden Gewebes hilfreich sein.
Zellen in mehrzelligen Organismen müssen Materie austauschen und kommunizieren, um ihr kollektives Überleben zu sichern. Da jede Zelle von einer Lipidmembran umgeben ist, die für viele biologische Moleküle undurchdringlich ist, hat die Evolution Mechanismen hervorgebracht, mit denen diese Barriere überwunden werden kann. Signalrezeptoren, Transporter und Poren leiten Informationen weiter und ermöglichen den Durchgang von Molekülen zwischen Zellen und ihrer Außenseite, während Zellkontakte wie Gap Junctions das Innere benachbarter Zellen direkt verbinden und die Diffusion kleiner Moleküle von Zelle zu Zelle ermöglichen.
Um diese Prozesse in künstlichen Systemen nachzuahmen, „haben Forscher nebeneinander positionierte synthetische Zellen entwickelt, die über Proteinporen auf ihren Membranen kommunizieren können“, erklärt Erstautor Yi Li, der die Studie mitleitete. „Allerdings ist die Entwicklung synthetischer Zellsysteme, bei denen Zellen über größere Entfernungen kommunizieren und Materialien austauschen können, immer noch eine Herausforderung.“
Die Proteinstrukturen, die in der Biologie die Kommunikation von Zelle zu Zelle ermöglichen, werden „von unten nach oben“ aus Aminosäuren aufgebaut – die in ihrer Sequenz kodierten Informationen werden in eine Struktur übersetzt. Ein weiteres biologisches Makromolekül, die DNA, wird hauptsächlich zur Informationsspeicherung in Zellen verwendet; Aufgrund der einfachen Synthese und des Potenzials zur Bildung hochgradiger Strukturen ist das Gebiet der DNA-Nanotechnologie jedoch weit über den ersten Proof-of-Concept vor etwa 30 Jahren hinausgegangen. Seitdem haben Wissenschaftler immer ausgefeiltere 2D- und 3D-Strukturen aus DNA zusammengesetzt, darunter Gitter, Röhren, geometrische Körper und sogar künstlerische Darstellungen von Smileys, was als DNA-Origami bezeichnet wird.
In ihrer Studie kombinierten die Forscher des Schulman Lab DNA-Origami-Nanoporen, die die Membranen zellähnlicher Vesikel überbrücken und kleine Öffnungen für die Durchquerung von Molekülen schaffen, mit konstruierten selbstorganisierenden DNA-Nanoröhren. Durch die Quantifizierung des Flusses eines Farbstoffmoleküls in die Vesikel zeigten sie, dass kurze Nanoporen die Membran für den Farbstoff durchlässig machten. Sie bestätigten außerdem, dass die Geschwindigkeit dieses Transports mit der Diffusion übereinstimmt, und fanden heraus, dass eine speziell entwickelte DNA-Kappe die Poren verstopfen und das Eindringen des Farbstoffs verhindern kann.

Anschließend weitete das Team diese Arbeit auf DNA-Nanoröhren mit einer mittleren Länge von 700 nm und einem Maximum von über 2 µm aus. Auch hier zeigten Experimente, dass der Farbstoffeinstrom in Gegenwart der DNA-Konstrukte verstärkt wird und dass die Kappe die Permeation stoppen kann. Die Schlussfolgerung, sagt Li, ist, dass „kleine Moleküle ohne Lecks durch die Röhren gelangen können, und wir gehen davon aus, dass auch große Moleküle wie Proteine durch diese Nanoröhren transportiert werden können“.
Mitglieder der Aksimentiev-Gruppe führten Brownsche Dynamik-Computersimulationen des Nanoporen-Farbstoff-Systems durch. Diese zeigten, dass bei Molekülen unterhalb einer Schwellengröße die Leckage durch die Seitenwand des DNA-Röhrchens den Zustrom dominiert, während bei größeren Molekülen die Ende-zu-Ende-Diffusion der bevorzugte Mechanismus wird.
Li erklärt, dass solche Simulationen Experimente auf zwei Arten ergänzen. „Sie können als Designwerkzeuge verwendet werden, um Forschern dabei zu helfen, nanoskalige Strukturen mit spezifischen Funktionen zu entwerfen“, sagt er, indem sie beispielsweise „die Selbstorganisationskinetik unserer DNA-Nanostrukturen simulieren“, aber sie helfen auch, „experimentelle Ergebnisse zu validieren und bereitzustellen.“ zusätzliche Einblicke in die physikalischen Prozesse“.

DNA-Design zum Selbermachen
Rebecca Schulman – Co-Leiterin der Forschung – zieht eine Analogie zu Rohren. „Diese Studie weist sehr stark darauf hin, dass es möglich ist, Nanoröhren zu bauen, die nicht auslaufen, indem man diese einfachen Selbstorganisationstechniken verwendet, bei denen wir Moleküle in einer Lösung mischen und sie einfach die gewünschte Struktur bilden lassen.“ In unserem Fall können wir diese Rohre auch an verschiedenen Endpunkten befestigen, um so etwas wie eine Rohrleitung zu bilden.“
Das Labor hat ehrgeizige Pläne für die Anwendung dieser Nanoröhren. „Zukünftige Entwicklungen umfassen die Verbindung von zwei oder mehr künstlichen Zellen mit unseren DNA-Nanoröhren und die Darstellung des molekularen Transports zwischen ihnen. Wir können möglicherweise zeigen, dass der Transport von Signalmolekülen aus einer Zelle die Genexpression in einer anderen Zelle aktivieren/deaktivieren kann“, erzählt Li Physik-Welt. Das Team hofft auch, „Nanoröhren zu nutzen, um die Abgabe von Signalmolekülen oder Therapeutika an Säugetierzellen zu kontrollieren, entweder um das Signalverhalten der Zellen zu untersuchen oder um eine Strategie zur Arzneimittelabgabe zu entwickeln“.