Die Partikeltherapie – eine Krebsbehandlung mit Protonen- oder schwereren Ionenstrahlen – bietet eine hochgradig konforme Dosisabgabe und eine größere Schonung des normalen Gewebes als die herkömmliche photonenbasierte Strahlentherapie. Für Langzeitüberlebende einer Krebserkrankung ist jedoch das Risiko eines strahleninduzierten Sekundärkrebses (SC) wichtig und sollte bei der Auswahl ihrer Behandlungsmethode berücksichtigt werden.
Da epidemiologische Daten für neuere Behandlungen wie die Protonen- und Kohlenstoffionentherapie rar sind, leitete ein Team das GSI Helmholtzzentrum für Schwerionenforschung entwickelt ein Modell zum Vergleich der SC-Risiken zwischen Partikeltherapiemodalitäten. Das Modell, beschrieben von Antonia Hufnagl und Kollegen darin Medizinische Physik, könnte letztendlich in Behandlungsplanungssysteme integriert werden, um das SC-Risiko als zusätzliches Optimierungskriterium einzubeziehen.
Tödliche versus krebserregende Ereignisse
SC-Risikomodelle funktionieren typischerweise, indem sie das Gleichgewicht zwischen Zelltötung (was zur Krebsunterdrückung führt) und Zelltransformation (Induktion von Mutationen, die schließlich zu Krebs führen) berücksichtigen. Die Wahrscheinlichkeit, dass ein bestrahltes Volumen Krebs entwickelt, wird mithilfe des linear-quadratischen (LQ)-Modells definiert, das eine einfache Beziehung zwischen Zellüberleben und abgegebener Photonendosis liefert.
In dieser Studie verwendeten die Forscher das lokale Effektmodell (LEM), um die relative biologische Wirksamkeit (RBE) der SC-Induktion nach Partikeltherapie vorherzusagen. Um die erhöhte RBE der Partikelstrahlung zu berücksichtigen, ersetzten sie die Photonen-LQ-Parameter im Risikomodell durch die vom LEM vorhergesagten Ionenstrahl-LQ-Parameter. Ein wesentliches Merkmal ihres Ansatzes ist die Verwendung des LEM sowohl zur Zelltötung als auch zur Krebsinduktion.

„Die doppelte Verwendung des LEM spiegelt den Wettbewerb zwischen den beiden Hauptprozessen wider, die die SC-Entwicklung bestimmen, nämlich Zelltransformation und Zelltötung“, erklärt der leitende Autor Michael Scholz. „Mit zunehmender Dosis und/oder Wirksamkeit kann die Zelltötung die Lebensfähigkeit transformierter Zellen unterdrücken. Dies führt zu einem komplexen Zusammenspiel, das nicht einfach anders in einem einstufigen Verfahren abgebildet werden kann.“
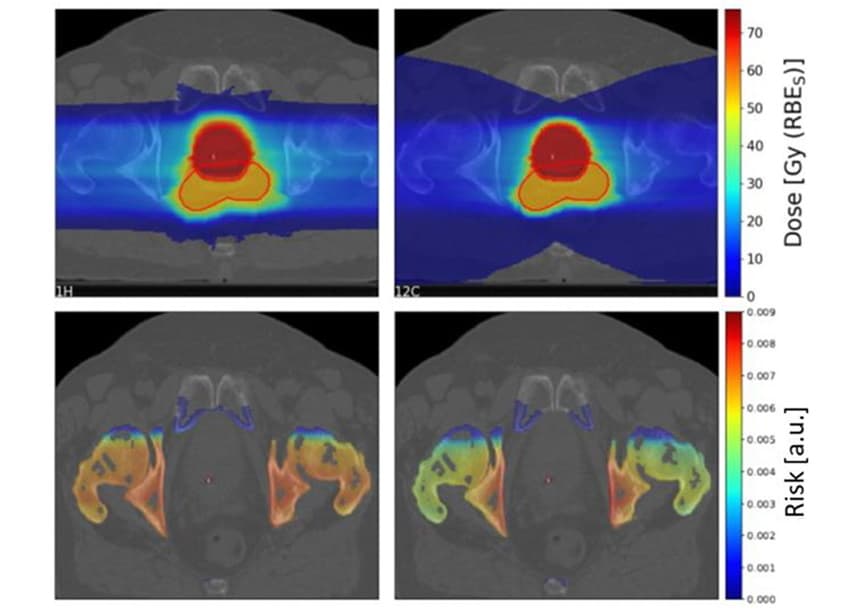
Um zu untersuchen, welche Faktoren das SC-Risiko beeinflussen, verwendeten die Forscher das TPS TRiP98-Planungssystem, um biologisch optimierte Kohlenstoffionen- und Protonenbehandlungspläne auf der Grundlage einer idealisierten Geometrie zu erstellen. Die Pläne bestrahlten ein 4 x 4 x 4 cm großes Ziel mit einem einzelnen Partikelstrahl oder zwei entgegengesetzten Strahlen, wobei sich vor dem Ziel ein 4 x 4 x 1 cm großes gefährdetes Organ (OAR) befand. Aufgrund von Unsicherheiten bei den Photonen-LQ-Parametern, die als Eingabe für das LEM verwendet wurden, schätzten sie die Risikoverhältnisse von Protonen zu Kohlenstoffionen und nicht einzelne Risikowerte.
Für diese idealisierten Anordnungen zeigte das Modell keine eindeutige Präferenz für Protonen oder Kohlenstoffionen, sondern eine komplexe Abhängigkeit von verschiedenen Parametern. Die verringerte seitliche Streuung von Kohlenstoffionen führt zu einem geringeren SC-Risiko als Protonen im Eintrittskanal. Aufgrund des Fragmentierungsschwanzes deponieren Kohlenstoffionen jedoch eine höhere Dosis hinter dem Ziel, was das SC-Risiko für OARs hinter dem Tumor nach der Bestrahlung mit Kohlenstoffionen erhöht.
Bei Einzelstrahlplänen war das gesamte SC-Risiko für Kohlenstoffionen etwa 1.5-mal höher als für Protonen. Bei zwei gegenläufigen Strahlen war das gesamte SC-Risiko für Protonen um das 1.16-fache höher, wobei dieses je nach räumlicher Lage des angenommenen sensiblen Volumens im Verhältnis zum Zielvolumen stark schwankte.
Die Strahlenempfindlichkeit des Gewebes (gegenüber Photonen) hatte einen großen Einfluss auf das SC-Risikoverhältnis, wobei strahlenresistente OARs von der Behandlung mit Kohlenstoffionen und empfindliche OARs von Protonenstrahlen profitierten. Im Gegensatz dazu hatte das Fraktionierungsschema nur geringe Auswirkungen auf die erwarteten Risikowerte.
Patientengeometrie
Um klinische Szenarien zu untersuchen, schätzten Scholz und Kollegen die SC-Risiken für 10 Prostatakrebspatienten, die zuvor am Karolinska-Universitätskrankenhaus mit Photonenstrahlentherapie behandelt wurden. Sie erstellten Behandlungspläne für die Patienten mithilfe zweier seitlich gegenüberliegender gescannter Protonen- und Kohlenstoffionenfelder.
Wie bereits zuvor gesehen, führte der Fragmentierungsschweif von Kohlenstoffionen zu einem großen Bereich mit niedriger Dosis hinter dem Ziel. Allerdings war die Hochdosis-Zielregion für das Kohlenstoff-Ion konformer als die Protonenpläne.
Das Team berechnete die SC-Risikoverhältnisse von Protonen zu Kohlenstoffionen für vier OARs (Blase, Rektum, Knochen und Haut) für die zehn Patienten. Für Knochen und Haut ergaben Protonenpläne ein etwas höheres SC-Risiko als Kohlenstoffionenpläne, mit mittleren Risikoverhältnissen von 10 bzw. 1.19 für Knochen und Haut. Für Blase und Rektum führten Protonenpläne jedoch zu deutlich geringeren SC-Risiken, mit Risikoverhältnissen von 1.06 bzw. 0.68 für Blase und Rektum.
Die Forscher kommen zu dem Schluss, dass die Erkenntnisse dieses Modells dazu beitragen könnten, zukünftige Behandlungen zu optimieren. Derzeit eignet sich die relative Risikomodellierung vor allem als Werkzeug zum Vergleich verschiedener Behandlungsszenarien für verschiedene Patientenkohorten. Scholz weist jedoch darauf hin, dass die Einbeziehung solcher Modelle in die Behandlungsplanung für einzelne Patienten unkompliziert wäre.

Die Kohlenstoff-Ionen-Gittertherapie schont gesundes Gewebe
„Es ist lediglich erforderlich, die Planung für eine bestimmte Dosisverteilung mit zwei verschiedenen biologischen Parametersätzen durchzuführen, die den Zelltötungs- bzw. den Zelltransformationsprozess darstellen“, erklärt er. „Dann ist nur noch eine gewisse Nachbearbeitung der resultierenden 3D-Effektverteilungen mit standardmäßigen mathematischen Werkzeugen erforderlich, um die entsprechenden Risikoverhältnisverteilungen abzuleiten.“
Der nächste Schritt besteht seiner Meinung nach darin, das Modell durch Vergleich mit klinischen Daten zu validieren. „Da diese Daten derzeit knapp sind, wäre eine Ausweitung des Ansatzes auf Photonenbehandlungen und die Bestimmung der entsprechenden Risikoverhältnisse von Protonen zu Photonen und Kohlenstoffionen zu Photonen ein wichtiger nächster Schritt“, sagt Scholz Physik-Welt.