
Die Fähigkeit, Elektronik und optische Sensoren auf Einzelzellenebene mit dem menschlichen Körper zu verschmelzen, könnte eines Tages die Fernüberwachung und -steuerung einzelner Zellen in Echtzeit ermöglichen. Fortschritte in der Elektronikfertigung haben die Herstellung von Transistoren und Sensoren mit nanoskaliger Auflösung ermöglicht, während innovative Nanostrukturierungstechniken die Montage dieser Geräte auf flexiblen Substraten ermöglichen. Solche Prozesse erfordern jedoch im Allgemeinen aggressive Chemikalien, hohe Temperaturen oder Vakuumtechniken, die für lebende Zellen und Gewebe ungeeignet sind.
Um diese Hindernisse zu überwinden, hat ein Forschungsteam der Johns Hopkins University ein ungiftiges, hochauflösendes und kostengünstiges Verfahren zum Drucken von Goldnanomustern auf lebendes Gewebe und Zellen entwickelt. Veröffentlichung ihrer Ergebnisse in Nano-BuchstabenSie zeigen, dass die neue Technik lebende Zellen und Gewebe mit flexiblen Anordnungen von Gold-Nanopunkten und Nanodrähten „tätowieren“ kann. Letztlich könnte die Methode genutzt werden, um intelligente Geräte mit lebendem Gewebe für Anwendungen wie Bionik und Biosensorik zu integrieren.
„Wenn wir Technologien hätten, um die Gesundheit isolierter Zellen zu verfolgen, könnten wir Krankheiten vielleicht viel früher diagnostizieren und behandeln und nicht warten, bis das gesamte Organ geschädigt ist“, erklärt Teamleiter David Gracias in einer Pressemitteilung. „Wir reden davon, so etwas wie ein elektronisches Tattoo auf einem lebenden Objekt anzubringen, das zehnmal kleiner ist als der Kopf einer Stecknadel. Es ist der erste Schritt zur Anbringung von Sensoren und Elektronik an lebenden Zellen.“
Thanks, Luo Gu und Kollegen haben ein dreistufiges Nanotransferdruckverfahren entwickelt, um Goldnanomuster an lebende Zellen zu binden. Im ersten Schritt verwendeten sie die konventionelle Nanoimprint-Lithographie (NIL), um Arrays aus Gold-Nanopunkten oder Nanodrähten auf polymerbeschichtete Siliziumwafer zu drucken. Anschließend lösten sie das Polymer auf und setzten die Nanoarrays für die Übertragung auf Glasdeckgläser frei.
Als nächstes funktionalisierten die Forscher die Goldoberfläche mit Cysteamin und überzogen die Gold-NIL-Arrays mit einer Alginat-Hydrogel-Transferschicht. Sie zeigten, dass mit diesem Ansatz 8 × 8 mm große Anordnungen von Nanopunkten und Nanodrähten zuverlässig vom Glas auf die weichen und flexiblen Hydrogele übertragen werden konnten. Im letzten Schritt werden die Gold-NIL-Arrays mit Gelatine konjugiert, um ihre Übertragung auf lebende Zellen oder Gewebe zu ermöglichen. Durch die Dissoziation der Hydrogel-Transferschicht wird dann das Goldmuster freigelegt.
Die Forscher untersuchten das Verhalten lebender Fibroblastenzellen, die auf Anordnungen von Goldpunkten mit 250 nm Durchmesser (Abstand von Mitte zu Mitte) oder 550 nm breiten Golddrähten (Abstand von 300 nm) auf Alginat-Hydrogelen ausgesät wurden. Etwa 450 Stunden nach der Aussaat wanderten die Zellen auf dem mit Nanodrähten bedruckten Hydrogel vorzugsweise parallel zu den Nanodrähten, während die Zellen auf den Nanopunkten eine zufällige, aber etwas schnellere Migration zeigten. Die Zellen auf den Nanodrähten zeigten außerdem eine etwa doppelt so große Dehnung wie die Zellen auf den Nanopunkten. Diese Ergebnisse belegen die Fähigkeit der Gold-NIL-Arrays, die Zellorientierung und -migration zu steuern.
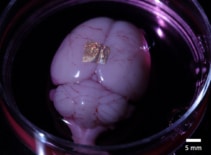
Alginat-Hydrogel ist nicht nur biokompatibel mit Zellen und Geweben, sondern kann auch Gold-NIL-Arrays auf lebende Organe und Zellen übertragen. Um dies zu demonstrieren, positionierten die Forscher mit Nanodrähten bedruckte Hydrogele auf der Großhirnrinde eines ganzen Gehirns und einer koronalen Hirnscheibe.
Nach 2 Stunden im Kulturmedium und der Dissoziation des Hydrogels blieben die Nanodrähte an der Oberfläche des gesamten Gehirns gebunden. Im Gegensatz dazu hafteten Nanodrähte auf der Hirnscheibe nicht, was darauf hindeutet, dass die Adhäsionsstärke je nach Zelltyp und Kulturmethode unterschiedlich ist. Die Forscher weisen darauf hin, dass weitere Studien erforderlich sind, um die Adhäsionsmechanismen für eine robuste Langzeitbindung zu charakterisieren und zu optimieren.
Um schließlich den Biotransferdruck auf Einzelzellebene zu bewerten, kultivierten die Forscher einschichtige Zellschichten auf mit Gold-NIL-Arrays bedruckten Alginathydrogelen. Nach 24 Stunden drehten sie die mit Fibroblasten besiedelten Hydrogele auf mit Gelatine beschichtete Deckgläser und ließen die Zellen über Nacht an den Deckgläsern haften.
Nach der Dissoziation des Alginat-Hydrogels ergab die Fluoreszenzmikroskopie, dass mit Gold-Nanopunkten gemusterte Fibroblasten eine Lebensfähigkeit von etwa 97 % aufwiesen, während mit Nanodrähten gemusterte Fibroblasten eine Lebensfähigkeit von etwa 98 % aufwiesen, was darauf hindeutet, dass der Druckprozess mit lebenden Zellen biokompatibel ist. Reflektierende Farben auf der gemusterten Fibroblasten-Zellschicht lassen darauf schließen, dass die Form des Gold-NIL-Arrays beibehalten wurde.
Der Herstellungsprozess ist auch mit der Mikrophotolithographie kompatibel, die es den Forschern ermöglichte, 200 µm breite sechseckige und dreieckige Flecken aus Gold-NIL-Arrays zu erzeugen. Anschließend druckten sie diese per Biotransfer auf Zellschichten, was zu einem selektiven Wachstum von Fibroblastenzellen auf den Mikropflastern führte. Über einen Zeitraum von 16 Stunden aufgezeichnete Filme zeigten, dass Zellen mit darauf aufgedruckten Nanodrahtflecken gesund und migrationsfähig wirkten, wobei die Arrays auch während der Bewegung auf den weichen Zellen verblieben.

Winziger Sensor misst gleichzeitig elektrische und mechanische Aktivität in Herzzellen
„Wir haben gezeigt, dass wir komplexe Nanomuster an lebende Zellen anbringen und gleichzeitig sicherstellen können, dass die Zelle nicht stirbt“, sagt Gracias. „Es ist ein sehr wichtiges Ergebnis, dass die Zellen mit den Tätowierungen leben und sich bewegen können, da es oft eine erhebliche Inkompatibilität zwischen lebenden Zellen und den Methoden gibt, die Ingenieure zur Herstellung von Elektronik verwenden.“
Gracias und Kollegen kommen zu dem Schluss, dass ihr Nanostrukturierungsprozess in Kombination mit Standard-Mikrofabrikationstechniken „Möglichkeiten für die Entwicklung neuer Zellkultursubstrate, Biohybridmaterialien, bionischer Geräte und Biosensoren eröffnet“. Als nächstes wollen sie versuchen, komplexere Nanoschaltkreise anzubringen, die über einen längeren Zeitraum an Ort und Stelle bleiben können, und mit verschiedenen Zelltypen experimentieren.
- SEO-gestützte Content- und PR-Distribution. Holen Sie sich noch heute Verstärkung.
- PlatoData.Network Vertikale generative KI. Motiviere dich selbst. Hier zugreifen.
- PlatoAiStream. Web3-Intelligenz. Wissen verstärkt. Hier zugreifen.
- PlatoESG. Automobil / Elektrofahrzeuge, Kohlenstoff, CleanTech, Energie, Umwelt, Solar, Abfallwirtschaft. Hier zugreifen.
- PlatoHealth. Informationen zu Biotechnologie und klinischen Studien. Hier zugreifen.
- ChartPrime. Verbessern Sie Ihr Handelsspiel mit ChartPrime. Hier zugreifen.
- BlockOffsets. Modernisierung des Eigentums an Umweltkompensationen. Hier zugreifen.
- Quelle: https://physicsworld.com/a/researchers-tattoo-gold-nanopatterns-onto-live-cells/
- :hast
- :Ist
- :nicht
- $UP
- 16
- 200
- 24
- 8
- a
- Fähigkeit
- Fähig
- LiveBuzz
- Aktivität
- haften
- Vorschüsse
- Nach der
- ebenfalls
- unter
- an
- und
- erschienen
- Anwendungen
- Ansatz
- ca.
- SIND
- um
- Feld
- AS
- Versammlung
- beurteilen
- At
- anhängen
- BE
- weil
- Sein
- zwischen
- Körper
- Anleihe
- Gehirn
- aber
- CAN
- Die Zellen
- charakterisieren
- klicken Sie auf
- Kopien
- kombiniert
- kompatibel
- Komplex
- Schluss
- Kontrast
- Smartgeräte App
- konventionellen
- kostengünstiger
- könnte
- erstellen
- KULTUR
- Tag
- zeigen
- entworfen
- entwickelt
- Entwicklung
- Geräte
- DID
- Sterben
- anders
- Krankheiten
- Tut nicht
- Früher
- elektronisch
- Elektronik
- ermöglichen
- freigegeben
- Ingenieure
- Gewährleistung
- Ganz
- Sogar
- Erklärt
- beschleunigt
- Finale
- Befund
- Vorname
- flexibel
- Aussichten für
- für
- weiter
- GAO
- allgemein
- Glas
- Gold
- Wachstum
- Guide
- hätten
- Haben
- ganzer
- Gesundheit
- gesund
- Herz
- GUTE
- hochauflösenden
- hopkins
- aber
- HTTPS
- human
- Image
- wichtig
- in
- Krankengymnastik
- Information
- innovativ
- integrieren
- isoliert
- Problem
- IT
- johns
- Johns Hopkins University
- jpg
- Schicht
- Führer
- führenden
- lassen
- Niveau
- Gefällt mir
- leben
- Leben
- langfristig
- länger
- gemacht
- Materialien
- max-width
- vielleicht
- Maßnahmen
- mechanisch
- Mechanismen
- Medien
- Merge
- Methode
- Methoden
- Mikroskopie
- migriert
- migriert
- Migration
- Überwachung
- mehr
- schlauer bewegen
- gerührt
- Filme
- viel
- erforderlich
- Neu
- weiter
- Objekt
- Hindernisse
- of
- vorgenommen,
- on
- EINEM
- auf zu
- XNUMXh geöffnet
- Entwicklungsmöglichkeiten
- Optimieren
- or
- übrig
- Überwinden
- über Nacht
- Parallel
- Patches
- Schnittmuster
- Zeiträume
- Physik
- Physik-Welt
- Ort
- Plan
- Plato
- Datenintelligenz von Plato
- PlatoData
- positioniert
- möglich
- Presse
- Prozessdefinierung
- anpassen
- Putting
- zufällig
- RAT
- echt
- Echtzeit
- aufgezeichnet
- blieb
- verbleibenden
- entfernt
- Reporting
- erfordern
- Forschungsprojekte
- Forscher
- Auflösung
- Folge
- Revealed
- robust
- rund
- sagt
- gesehen
- selektiv
- Sensoren
- Form
- Blatt
- zeigte
- gezeigt
- signifikant
- Silizium
- gleichzeitig
- Slice
- kleinere
- smart
- SOFT
- etwas
- Standard
- Erklärung
- bleiben
- Schritt
- Stärke
- Es wurden Studien
- so
- vorschlagen
- Oberfläche
- sprechen
- Team
- Techniken
- Technologies
- Zehn
- als
- zur Verbesserung der Gesundheitsgerechtigkeit
- Das
- ihr
- dann
- Diese
- vom Nutzer definierten
- fehlen uns die Worte.
- diejenigen
- Daumennagel
- Zeit
- mal
- zu
- Top
- gegenüber
- verfolgen sind
- privaten Transfer
- behandeln
- was immer dies auch sein sollte.
- versuchen
- Twice
- Typen
- Letztlich
- Universität
- bis
- -
- benutzt
- Vakuum
- sehr
- Durchführbarkeit
- warten
- wurde
- we
- GUT
- während
- welche
- während
- ganze
- breit
- mit
- weltweit wie ausgehandelt und gekauft ausgeführt wird.
- Zephyrnet












