Stellen Sie sich eine Armee selbstfahrender, mit Radioisotopen bedeckter Partikel vor, die 2500 bis 10,000 Mal kleiner als ein Staubkorn sind und nach der Injektion in den Körper nach Krebstumoren suchen, sich daran festsetzen und diese zerstören. Klingt nach Science-Fiction? Nicht so bei Mäusen mit Blasenkrebs.
Forscher in Spanien berichten, dass Nanopartikel, die radioaktives Jod enthalten und sich bei Reaktion mit Harnstoff antreiben, in der Lage sind, krebsartige Blasentumoren von gesundem Gewebe zu unterscheiden. Diese „Nanobots“ dringen in die extrazelluläre Matrix des Tumors ein und reichern sich dort an, sodass die Radionuklidtherapie genau ihr Ziel erreichen kann. In einer Studie, die am durchgeführt wurde Institut für Bioengineering von Katalonien (IBEC) in Barcelona zeigten Mäuse, die eine Einzeldosis dieser Behandlung erhielten, eine 90-prozentige Verringerung der Größe von Blasentumoren im Vergleich zu unbehandelten Tieren.
Dieser neuartige Ansatz könnte eines Tages die Behandlung von Blasenkrebs revolutionieren. Nach Angaben des Global Cancer Observatory der Weltgesundheitsorganisation ist Blasenkrebs mit über 600,000 neu diagnostizierten Fällen im Jahr 2022 und mehr als 220,000 Todesfällen weltweit die zehnthäufigste Krebsart weltweit.
Nicht muskelinvasiver Blasenkrebs, der 75 % der Fälle ausmacht, wird derzeit durch Tumorresektion und anschließende intravesikale Injektion von Chemotherapie- oder Immuntherapeutika in die Blase behandelt. Die Medikamentenverabreichung stellt jedoch eine besondere Herausforderung dar, da das Urothel (das Gewebe, das die Innenseite der Harnwege auskleidet) wenig durchlässig ist, der Urin mit Inhalt gefüllt ist und die Medikamente anschließend ausgewaschen werden. Der Vorgang ist auch für die Patienten unangenehm, da sie in Bauchlage ihren Körper in regelmäßigen Abständen drehen müssen, damit die Medikamente alle Seiten der Blasenwand erreichen können. Nach der Behandlung besteht ein 30–70 %iges Risiko für ein erneutes Auftreten innerhalb von fünf Jahren.
Zur Verbesserung der klinischen Ergebnisse, Hauptforscher Samuel Sánchez und Kollegen wollen innovative und wirksamere Behandlungen für Blasenkrebs entwickeln und dabei die Rezidivraten senken. Darüber hinaus würde eine Einzeldosistherapie die Behandlungskosten, die derzeit zwischen sechs und 14 Krankenhausaufenthalten erfordern, erheblich senken.
Das Team schuf Nanobots aus mesoporösen Silica-Nanopartikeln mit verschiedenen funktionellen Komponenten auf ihren Oberflächen. Dazu gehören Radioisotope für die PET-Visualisierung oder Radionuklidtherapie sowie das Protein Urease, das mit Harnstoff im Urin reagiert und den Antrieb des Nanobots ermöglicht.
Schreiben in Natur Nanotechnologie, berichten die Forscher, dass die Nanobots eine Schwarmbewegung zeigten, als sie einer Lösung mit 300 mM Harnstoff einen Tropfen Nanobots hinzufügten und dabei aktive und kräftige Fronten und dreidimensionale Wirbel bildeten. Ohne den Harnstoff sedimentierten die Nanobots einfach in der Nähe der Zugabestelle.
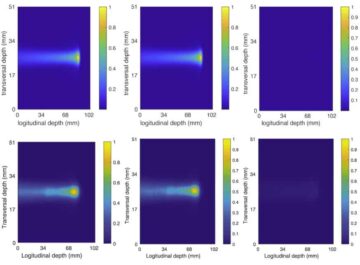
Es soll untersucht werden, ob die Nanobots einen Tumor erreichen können in vivoDas Team untersuchte ihr Verhalten bei tumortragenden Mäusen. Bilder der Positronenemissionstomographie (PET) zeigten, dass Signale von radioaktiv markierten Nanobots zusammen mit der mittels MRT bestimmten Tumorposition lokalisiert waren, wobei die Radioaktivität hauptsächlich an der Zieltumorstelle beobachtet wurde. Nur Mäuse, denen Nanobots plus Harnstoff injiziert wurden, zeigten eine erhebliche Anreicherung in der Tumormasse – Nanobots, die in Wasser verabreicht wurden, und Kontroll-Nanopartikel (ohne Urease), die in Wasser oder Harnstoff verabreicht wurden, zeigten eine minimale Tumoraufnahme.
Die Forscher vermuten, dass die Mobilität der Nanobots ihnen hilft, in die Tumormasse einzudringen. „Nanorobotern fehlen spezifische Antikörper, um den Tumor zu erkennen, und Tumorgewebe ist typischerweise steifer als gesundes Gewebe, aber das ist bei Blasentumoren nicht der Fall“, erklärt Co-Erstautor Meritxell Serra Casablancas von IBEC. „Wir haben beobachtet, dass diese Nanoroboter die extrazelluläre Matrix des Tumors abbauen können, indem sie den pH-Wert durch eine selbstantreibende chemische Reaktion lokal erhöhen. Dieses Phänomen begünstigte eine stärkere Tumorpenetration.“ Die Forscher glauben, dass die Nanobots mit dem Urothel kollidieren, als wäre es eine Wand, aber in den Tumor eindringen, der schwammiger ist.
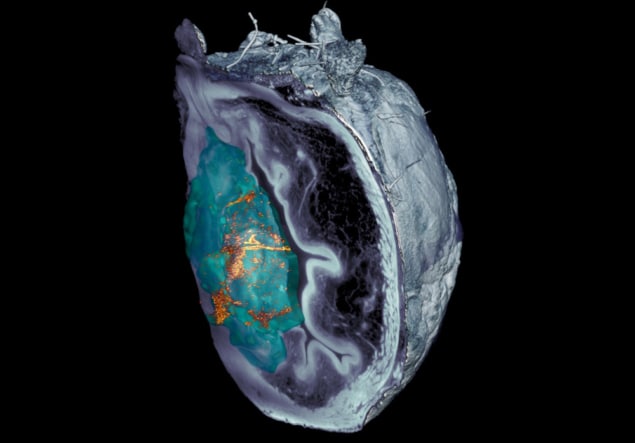
Das Team stellte fest, dass die Identifizierung der Nanobots in Mikroskopbildern von präpariertem Gewebe eine Herausforderung darstellte. Nachdem konfokale optische Mikroskopietechniken versagt hatten, haben Forscher von IRB Barcelona entwickelte ein lichtblattbasiertes Mikroskopiesystem, das auf planarer Laserbeleuchtung basiert und in der Lage ist, die verschiedenen Schichten der Blase zu scannen und eine 3D-Rekonstruktion des gesamten Organs zu erstellen.
„Das von uns entwickelte System der gestreuten elastischen Lichtblattmikroskopie ermöglichte es uns, das vom Tumor selbst reflektierte Licht zu eliminieren und so Nanopartikel im gesamten Organ ohne vorherige Markierung mit beispielloser Auflösung zu identifizieren und zu lokalisieren“, sagt er Julien Colombelli vom IRB Barcelona.

Gentechnisch veränderte Bakterien locken krebstötende Radioisotope in Tumore
Um die therapeutische Wirkung der Technik zu bewerten, markierte das Team Nanobots mit dem Jod-131 (131I, ein Radioisotop, das üblicherweise für die Radionuklidtherapie verwendet wird) und verabreichte sie den tumortragenden Mäusen. Behandlung mit Losdosis 131I-Nanobots in Harnstoff stoppten das Tumorwachstum, obwohl sie hochdosiert waren 131In Harnstoff verabreichte I-Nanobots führten im Vergleich zu nicht behandelten Tieren zu einer Reduzierung des Tumorvolumens um fast 90 %.
Sánchez erzählt Physik-Welt dass die nächsten Schritte des Teams darin bestehen, kleine Medikamente zu verkapseln, die derzeit in der Chemotherapie verwendet werden, und die Effizienz von Nanobots als Medikamententräger weiter zu testen. Sie beabsichtigen schließlich, die Nanobots zu vergrößern und die regulatorischen Wege zu untersuchen, um über das IBEC-Spin-off in den nächsten drei bis vier Jahren zu den ersten klinischen Studien zu gelangen Nanobots-Therapeutika.
- SEO-gestützte Content- und PR-Distribution. Holen Sie sich noch heute Verstärkung.
- PlatoData.Network Vertikale generative KI. Motiviere dich selbst. Hier zugreifen.
- PlatoAiStream. Web3-Intelligenz. Wissen verstärkt. Hier zugreifen.
- PlatoESG. Kohlenstoff, CleanTech, Energie, Umwelt, Solar, Abfallwirtschaft. Hier zugreifen.
- PlatoHealth. Informationen zu Biotechnologie und klinischen Studien. Hier zugreifen.
- Quelle: https://physicsworld.com/a/self-propelling-nanobots-shrink-bladder-tumours-in-mice-by-90/
- :Ist
- :nicht
- $UP
- 000
- 10
- 135
- 14
- 2022
- 220
- 300
- 3d
- 600
- a
- Fähigkeit
- Nach
- Trading Konten
- Akkumulieren
- Anhäufung
- aktiv
- hinzugefügt
- Zusatz
- zusätzlich
- verabreicht
- Nach der
- Ziel
- Alle
- Zulassen
- ebenfalls
- an
- und
- Tiere
- Ansatz
- SIND
- Armee
- verhaftet
- AS
- bewertet
- At
- anhängen
- anziehen
- Autor
- Bakterien
- Barcelona
- basierend
- Verhalten
- Glauben
- zwischen
- Körper
- Körper
- Break
- aber
- by
- CAN
- Krebs
- fähig
- Träger
- Häuser
- Fälle
- herausfordernd
- chemisch
- Klinische
- klinische Versuche
- Kopien
- Kollidieren
- COM
- gemeinsam
- häufig
- verglichen
- Komponenten
- durchgeführt
- Inhalt
- fortsetzen
- Smartgeräte App
- Kosten
- erstellt
- Erstellen
- Zur Zeit
- Tag
- Todesfälle
- geliefert
- Lieferanten
- entschlossen
- entwickeln
- entwickelt
- anders
- unterscheiden
- empfohlen
- nach unten
- Medikament
- Drogen
- zwei
- Staub
- bewirken
- Effektiv
- Effizienz
- beseitigen
- Emission
- ermöglichen
- freigegeben
- ermöglicht
- ermöglichen
- Ganz
- EU
- bewerten
- schließlich
- untersuchen
- ausgestellt
- Erklärt
- Gescheitert
- Fiktion
- Füllung
- Vorname
- fünf
- gefolgt
- Folgende
- Aussichten für
- vier
- für
- funktional
- Global
- Global
- mehr
- Wachstum
- hätten
- Haben
- Gesundheit
- gesund
- hilft
- aber
- HTTPS
- identifizieren
- Identifizierung
- if
- Bilder
- Immuntherapie
- zu unterstützen,
- in
- das
- zunehmend
- Information
- innovativ
- innerhalb
- wollen
- in
- Problem
- IT
- SEINE
- selbst
- jpg
- Kennzeichnung
- Mangel
- laser
- Lagen
- geführt
- !
- Gefällt mir
- Futter
- örtlich
- Sneaker
- Masse
- Matrix
- max-width
- Kann..
- Mikroskopie
- minimal
- Mobilität
- mehr
- vor allem warme
- Bewegung
- schlauer bewegen
- MRI
- Natur
- In der Nähe von
- fast
- Need
- Neu
- weiter
- beachten
- Roman
- Sternwarte
- of
- on
- EINEM
- einzige
- or
- Ergebnisse
- übrig
- besonders
- Wegen
- Patienten
- Eindringen
- Phänomen
- Physik
- Physik-Welt
- Plato
- Datenintelligenz von Plato
- PlatoData
- erfahren
- Position
- präzise
- in erster Linie
- Principal
- Vor
- Prozessdefinierung
- Treiben
- Antrieb
- Proteine
- Honorar
- erreichen
- Reaktion
- Reagiert
- Empfang
- erkenne
- Wiederholung
- Veteran
- Reduktion
- reflektiert
- Regulierungsbehörden
- berichten
- erfordert
- Forscher
- Auflösung
- revolutionieren
- Risiko
- sagt
- Skalieren
- Scannen
- verstreut
- Wissenschaft
- Science-Fiction
- Suche
- gesehen
- zeigte
- Seiten
- Signale
- bedeutend
- einfach
- Single
- am Standort
- SIX
- Größe
- klein
- kleinere
- So
- Lösung
- Geräusche
- Spanien
- spezifisch
- Shritte
- Studie
- Folge
- wesentlich
- vorschlagen
- System
- Target
- Team
- Techniken
- erzählt
- Test
- als
- zur Verbesserung der Gesundheitsgerechtigkeit
- Das
- die Welt
- ihr
- Sie
- sich
- Therapie
- Diese
- vom Nutzer definierten
- fehlen uns die Worte.
- nach drei
- dreidimensional
- Durch
- während
- Daumennagel
- mal
- zu
- gegenüber
- behandelt
- Behandlungen
- Behandlungen
- Studien
- was immer dies auch sein sollte.
- WENDE
- typisch
- beispiellos
- auf
- Aufnahme
- us
- benutzt
- verschiedene
- Visualisierung
- Volumen
- Pinnwand
- wurde
- Wasser
- we
- waren
- wann
- ob
- welche
- während
- mit
- .
- ohne
- weltweit wie ausgehandelt und gekauft ausgeführt wird.
- würde
- Jahr
- Zephyrnet