Η σωματιδιακή θεραπεία - θεραπεία καρκίνου με χρήση δέσμης πρωτονίων ή βαρύτερων ιόντων - παρέχει εξαιρετικά ομοιόμορφη χορήγηση δόσης και μεγαλύτερη εξοικονόμηση φυσιολογικών ιστών από τη συμβατική ακτινοθεραπεία με βάση τα φωτόνια. Αλλά για τους μακροχρόνια επιζώντες καρκίνου, ο κίνδυνος δευτερογενούς καρκίνου (SC) που προκαλείται από ακτινοβολία είναι σημαντικός και θα πρέπει να λαμβάνεται υπόψη όταν επιλέγεται η μέθοδος θεραπείας τους.
Καθώς τα επιδημιολογικά δεδομένα σπανίζουν για νεότερες θεραπείες, όπως η θεραπεία με πρωτόνια και ιόντα άνθρακα, μια ομάδα ξεκίνησε στο GSI Helmholtz Center for Heavy Ion Research αναπτύσσει ένα μοντέλο για τη σύγκριση των κινδύνων SC μεταξύ των τρόπων θεραπείας με σωματίδια. Το μοντέλο, που περιγράφεται από Antonia Hufnagl και συνάδελφοι σε Ιατρική Φυσική, θα μπορούσε τελικά να ενσωματωθεί στα συστήματα σχεδιασμού θεραπείας για να συμπεριλάβει τον κίνδυνο SC ως πρόσθετο κριτήριο βελτιστοποίησης.
Θανατηφόρα έναντι καρκινογόνων συμβάντων
Τα μοντέλα κινδύνου SC λειτουργούν συνήθως λαμβάνοντας υπόψη την ισορροπία μεταξύ κυτταρικής θανάτωσης (που οδηγεί σε καταστολή του καρκίνου) και κυτταρικού μετασχηματισμού (επαγωγή μεταλλάξεων που τελικά οδηγούν σε καρκίνο). Η πιθανότητα ότι ένας ακτινοβολημένος όγκος θα αναπτύξει καρκίνο ορίζεται χρησιμοποιώντας το γραμμικό-τετραγωνικό μοντέλο (LQ), το οποίο παρέχει μια απλή σχέση μεταξύ της κυτταρικής επιβίωσης και της χορηγούμενης δόσης φωτονίου.
Σε αυτή τη μελέτη, οι ερευνητές χρησιμοποίησαν το μοντέλο τοπικού αποτελέσματος (LEM) για να προβλέψουν τη σχετική βιολογική αποτελεσματικότητα (RBE) της επαγωγής SC μετά τη θεραπεία με σωματίδια. Για να λάβουν υπόψη το αυξημένο RBE της ακτινοβολίας σωματιδίων, αντικατέστησαν τις παραμέτρους LQ φωτονίων στο μοντέλο κινδύνου με τις παραμέτρους LQ δέσμης ιόντων που προβλέπονται από το LEM. Ένα βασικό χαρακτηριστικό της προσέγγισής τους είναι η χρήση του LEM τόσο με τους όρους θανάτωσης κυττάρων όσο και με τους όρους πρόκλησης καρκίνου.

«Η διπλή χρήση του LEM αντικατοπτρίζει τον ανταγωνισμό μεταξύ των δύο μεγάλων διεργασιών που καθορίζουν την ανάπτυξη του SC, δηλαδή τον κυτταρικό μετασχηματισμό και τη θανάτωση κυττάρων», εξηγεί ο ανώτερος συγγραφέας. Michael Scholz. «Με την αύξηση της δόσης και/ή της αποτελεσματικότητας, η κυτταρική θανάτωση μπορεί να καταστείλει τη βιωσιμότητα των μετασχηματισμένων κυττάρων. Αυτό οδηγεί σε μια περίπλοκη αλληλεπίδραση, η οποία δεν μπορεί απλώς να αντικατοπτριστεί διαφορετικά σε μια διαδικασία ενός βήματος».
Για να διερευνήσουν ποιοι παράγοντες επηρεάζουν τον κίνδυνο SC, οι ερευνητές χρησιμοποίησαν το σύστημα σχεδιασμού TPS TRiP98 για να δημιουργήσουν βιολογικά βελτιστοποιημένα σχέδια επεξεργασίας ιόντων άνθρακα και πρωτονίων με βάση μια εξιδανικευμένη γεωμετρία. Τα σχέδια ακτινοβολούσαν έναν στόχο 4x4x4 cm με μία δέσμη σωματιδίων ή δύο αντίθετες δέσμες, με ένα όργανο σε κίνδυνο (OAR) 4x4x1 cm μπροστά από τον στόχο. Λόγω αβεβαιοτήτων στις παραμέτρους LQ φωτονίων που χρησιμοποιούνται ως είσοδος για το LEM, υπολόγισαν τους λόγους κινδύνου πρωτονίου προς ιόν άνθρακα, αντί για μεμονωμένες τιμές κινδύνου.
Για αυτές τις εξιδανικευμένες ρυθμίσεις, το μοντέλο δεν έδειξε ξεκάθαρη προτίμηση ούτε για πρωτόνια ούτε για ιόντα άνθρακα, αλλά αποκάλυψε μια πολύπλοκη εξάρτηση από διάφορες παραμέτρους. Η μειωμένη πλευρική σκέδαση των ιόντων άνθρακα οδηγεί σε χαμηλότερο κίνδυνο SC από τα πρωτόνια στο κανάλι εισόδου. Ωστόσο, τα ιόντα άνθρακα αποθέτουν υψηλότερη δόση πίσω από τον στόχο λόγω της ουράς κατακερματισμού, αυξάνοντας τον κίνδυνο SC για OARs πίσω από τον όγκο μετά από ακτινοβολία ιόντων άνθρακα.
Για σχέδια μονής δέσμης, ο συνολικός κίνδυνος SC ήταν περίπου 1.5 φορές υψηλότερος για τα ιόντα άνθρακα από ότι για τα πρωτόνια. Με δύο αντίθετες δέσμες, ο συνολικός κίνδυνος SC ήταν 1.16 φορές υψηλότερος για τα πρωτόνια, αν και αυτό ποικίλλει έντονα ανάλογα με τη χωρική θέση του υποτιθέμενου ευαίσθητου όγκου σε σχέση με τον όγκο στόχο.
Η ραδιοευαισθησία των ιστών (στα φωτόνια) είχε σημαντικό αντίκτυπο στην αναλογία κινδύνου SC, με τα ραδιοανθεκτικά OAR να επωφελούνται από την επεξεργασία ιόντων άνθρακα και τα ευαίσθητα OAR από δέσμες πρωτονίων. Αντίθετα, το σύστημα κλασμάτωσης είχε μικρή επίδραση στις αναμενόμενες τιμές κινδύνου.
Γεωμετρία ασθενούς
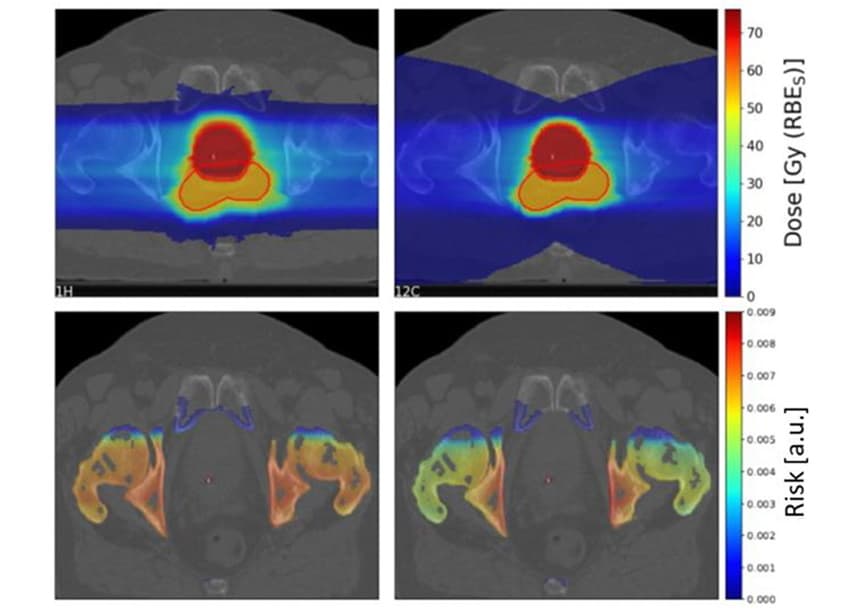
Για τη διερεύνηση κλινικών σεναρίων, ο Scholz και οι συνεργάτες του υπολόγισαν τους κινδύνους SC για 10 ασθενείς με καρκίνο του προστάτη που είχαν λάβει προηγουμένως ακτινοθεραπεία με φωτόνια στο Πανεπιστημιακό Νοσοκομείο Karolinska. Δημιούργησαν σχέδια θεραπείας για τους ασθενείς χρησιμοποιώντας δύο πλευρικά αντίθετα σαρωμένα πεδία πρωτονίων και ιόντων άνθρακα.
Όπως είδαμε προηγουμένως, η ουρά κατακερματισμού των ιόντων άνθρακα είχε ως αποτέλεσμα μια μεγάλη περιοχή χαμηλής δόσης πίσω από τον στόχο. Ωστόσο, η περιοχή στόχος υψηλής δόσης ήταν πιο σύμφωνη με το ιόν άνθρακα από τα σχέδια πρωτονίων.
Η ομάδα υπολόγισε τις αναλογίες κινδύνου SC ιόντων πρωτονίου προς άνθρακα για τέσσερα OAR (κύστη, ορθό, οστά και δέρμα) για τους 10 ασθενείς. Για τα οστά και το δέρμα, τα σχέδια πρωτονίων απέδωσαν ελαφρώς υψηλότερο κίνδυνο SC από τα σχέδια ιόντων άνθρακα, με μέσους λόγους κινδύνου 1.19 και 1.06 για τα οστά και το δέρμα, αντίστοιχα. Για την ουροδόχο κύστη και το ορθό, ωστόσο, τα σχέδια πρωτονίων οδήγησαν σε σημαντικά χαμηλότερους κινδύνους SC, με αναλογίες κινδύνου 0.68 και 0.49 για την κύστη και το ορθό, αντίστοιχα.
Οι ερευνητές καταλήγουν στο συμπέρασμα ότι οι γνώσεις που αποκτήθηκαν από αυτό το μοντέλο θα μπορούσαν να βοηθήσουν στη βελτιστοποίηση των μελλοντικών θεραπειών. Επί του παρόντος, η μοντελοποίηση σχετικού κινδύνου είναι κυρίως κατάλληλη ως εργαλείο για τη σύγκριση διαφορετικών σεναρίων θεραπείας για διαφορετικές ομάδες ασθενών. Αλλά ο Scholz σημειώνει ότι η ενσωμάτωση τέτοιων μοντέλων στον σχεδιασμό θεραπείας για μεμονωμένους ασθενείς θα ήταν απλή.

Η θεραπεία με πλέγμα ιόντων άνθρακα προστατεύει τον υγιή ιστό
«Απλώς απαιτείται η εκτέλεση του σχεδιασμού για μια δεδομένη κατανομή δόσης με δύο διαφορετικά σύνολα βιολογικών παραμέτρων που αντιπροσωπεύουν τη κυτταρική θανάτωση και τη διαδικασία κυτταρικού μετασχηματισμού, αντίστοιχα», εξηγεί. «Στη συνέχεια, χρειάζεται μόνο κάποια μεταεπεξεργασία των κατανομών 3D εφέ που προκύπτουν με τυπικά μαθηματικά εργαλεία για να εξαχθούν οι αντίστοιχες κατανομές αναλογιών κινδύνου».
Το επόμενο βήμα, λέει, είναι η επικύρωση του μοντέλου μέσω σύγκρισης με κλινικά δεδομένα. «Δεδομένου ότι επί του παρόντος αυτά τα δεδομένα είναι σπάνια, η επέκταση της προσέγγισης ώστε να περιλαμβάνει επίσης επεξεργασίες φωτονίων και ο καθορισμός των αντίστοιχων αναλογιών κινδύνου πρωτονίων έναντι φωτονίων και ιόντων άνθρακα έναντι φωτονίων θα ήταν ένα σημαντικό επόμενο βήμα», λέει ο Scholz. Κόσμος Φυσικής.