La terapia de partículas (tratamiento del cáncer que utiliza haces de protones o iones más pesados) proporciona una administración de dosis altamente conformada y una mayor conservación de los tejidos normales que la radioterapia convencional basada en fotones. Pero para los sobrevivientes de cáncer a largo plazo, el riesgo de cáncer secundario (SC) inducido por radiación es importante y debe tenerse en cuenta al seleccionar su modalidad de tratamiento.
Con datos epidemiológicos escasos para los tratamientos más nuevos, como la terapia de protones y de iones de carbono, un equipo dirigido en el Centro GSI Helmholtz para la investigación de iones pesados está desarrollando un modelo para comparar los riesgos de SC entre las modalidades de terapia con partículas. El modelo, descrito por antonia hufnagl y colegas en Física Médica, podría incorporarse en última instancia a los sistemas de planificación del tratamiento para incluir el riesgo de SC como un criterio de optimización adicional.
Eventos letales versus cancerígenos
Los modelos de riesgo de SC generalmente funcionan al considerar el equilibrio entre la muerte celular (que conduce a la supresión del cáncer) y la transformación celular (inducción de mutaciones que eventualmente conducen al cáncer). La probabilidad de que un volumen irradiado desarrolle cáncer se define utilizando el modelo cuadrático lineal (LQ), que proporciona una relación simple entre la supervivencia celular y la dosis de fotones administrados.
En este estudio, los investigadores utilizaron el modelo de efecto local (LEM) para predecir la efectividad biológica relativa (RBE) de la inducción de SC después de la terapia con partículas. Para tener en cuenta el aumento de RBE de la radiación de partículas, reemplazaron los parámetros LQ de fotones en el modelo de riesgo con los parámetros LQ de haz de iones predichos por el LEM. Una característica clave de su enfoque es el uso del LEM tanto en términos de muerte celular como de inducción de cáncer.

"El doble uso del LEM refleja la competencia entre los dos procesos principales que determinan el desarrollo de SC, a saber, la transformación celular y la muerte celular", explica el autor principal. Michael Scholz. “Con dosis y/o eficacia crecientes, la muerte celular puede suprimir la viabilidad de las células transformadas. Esto conduce a una interacción compleja, que no puede reflejarse simplemente de otra manera en un procedimiento de un solo paso”.
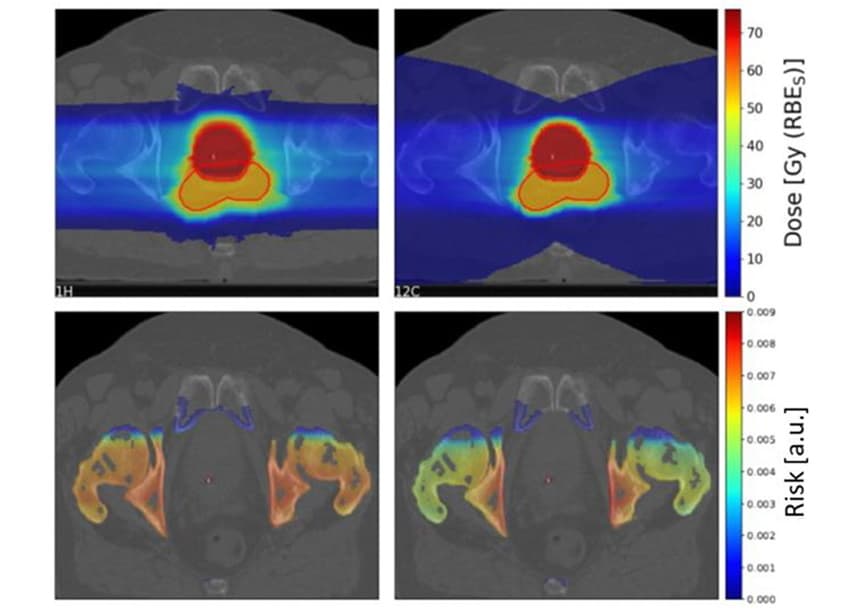
Para investigar qué factores afectan el riesgo de SC, los investigadores utilizaron el sistema de planificación TPS TRiP98 para generar planes de tratamiento de iones de carbono y protones biológicamente optimizados basados en una geometría idealizada. Los planes irradiaban un objetivo de 4x4x4 cm con un solo haz de partículas o dos haces opuestos, con un órgano en riesgo (OAR) de 4x4x1 cm frente al objetivo. Debido a las incertidumbres en los parámetros LQ de fotones utilizados como entrada para el LEM, estimaron las relaciones de riesgo de iones de protones a carbono, en lugar de los valores de riesgo individuales.
Para estas configuraciones idealizadas, el modelo no mostró una clara preferencia por los protones o los iones de carbono, pero reveló una dependencia compleja de varios parámetros. La dispersión lateral reducida de los iones de carbono conduce a un riesgo SC más bajo que los protones en el canal de entrada. Sin embargo, los iones de carbono depositan una dosis más alta detrás del objetivo debido a la cola de fragmentación, lo que aumenta el riesgo de SC de OAR detrás del tumor después de la irradiación con iones de carbono.
Para los planes de un solo haz, el riesgo total de SC fue aproximadamente 1.5 veces mayor para los iones de carbono que para los protones. Con dos haces opuestos, el riesgo SC total fue 1.16 veces mayor para los protones, aunque varió mucho según la ubicación espacial del volumen sensible supuesto con respecto al volumen objetivo.
La radiosensibilidad de los tejidos (a los fotones) tuvo un impacto importante en la relación de riesgo de SC, con OAR radiorresistentes que se beneficiaron del tratamiento con iones de carbono y OAR sensibles con haces de protones. En contraste, el esquema de fraccionamiento tuvo poco impacto en los valores de riesgo esperados.
Geometría del paciente
Para investigar escenarios clínicos, Scholz y sus colegas calcularon los riesgos de SC para 10 pacientes con cáncer de próstata tratados previamente con radioterapia de fotones en el Hospital Universitario Karolinska. Generaron planes de tratamiento para los pacientes utilizando dos campos de iones de carbono y protones escaneados lateralmente opuestos.
Como se vio anteriormente, la cola de fragmentación de los iones de carbono resultó en una gran área de baja dosis detrás del objetivo. Sin embargo, la región objetivo de dosis alta era más conforme para los planes de iones de carbono que para los de protones.
El equipo calculó las proporciones de riesgo de SC de iones de carbono a protones para cuatro OAR (vejiga, recto, huesos y piel) para los 10 pacientes. Para los huesos y la piel, los planes de protones arrojaron un riesgo SC ligeramente mayor que los planes de iones de carbono, con índices de riesgo medios de 1.19 y 1.06 para huesos y piel, respectivamente. Sin embargo, para la vejiga y el recto, los planes de protones resultaron en riesgos de SC significativamente más bajos, con índices de riesgo de 0.68 y 0.49 para la vejiga y el recto, respectivamente.
Los investigadores concluyen que los conocimientos adquiridos por este modelo podrían ayudar a optimizar futuros tratamientos. Actualmente, el modelado de riesgo relativo es principalmente adecuado como herramienta para comparar diferentes escenarios de tratamiento para diferentes cohortes de pacientes. Pero Scholz señala que la incorporación de dichos modelos en la planificación del tratamiento para pacientes individuales sería sencilla.

La terapia de rejilla de iones de carbono preserva el tejido sano
"Solo requiere ejecutar la planificación para una distribución de dosis dada con dos conjuntos de parámetros biológicos diferentes que representan el proceso de muerte celular y transformación celular, respectivamente", explica. "Entonces, solo se necesita un poco de procesamiento posterior de las distribuciones de efectos 3D resultantes con herramientas matemáticas estándar para derivar las distribuciones de relación de riesgo correspondientes".
El siguiente paso, dice, es validar el modelo mediante la comparación con los datos clínicos. "Dado que en la actualidad estos datos son escasos, la extensión del enfoque para incluir también tratamientos con fotones y determinar las proporciones de riesgo correspondientes de protones frente a fotones e iones de carbono frente a fotones sería un próximo paso importante", dice Scholz. Mundo de la física.