La capacidad de fusionar sensores electrónicos y ópticos con el cuerpo humano a nivel de una sola célula algún día podría permitir la monitorización y el control remotos de células individuales en tiempo real. Los avances en la fabricación de electrónica han hecho posible crear transistores y sensores con resolución a nanoescala, mientras que técnicas innovadoras de nanopatrones permiten ensamblar estos dispositivos sobre sustratos flexibles. Sin embargo, estos procesos generalmente requieren productos químicos agresivos, altas temperaturas o técnicas de vacío que no son adecuadas para células y tejidos vivos.
Para superar estos obstáculos, un equipo de investigación de la Universidad Johns Hopkins ha desarrollado un proceso no tóxico, de alta resolución y rentable para imprimir nanopatrones de oro en células y tejidos vivos. Informar sus hallazgos en Nano Letters, demuestran que la nueva técnica puede "tatuar" células y tejidos vivos con matrices flexibles de nanopuntos y nanocables de oro. En última instancia, el método podría utilizarse para integrar dispositivos inteligentes con tejido vivo para aplicaciones como la biónica y la biodetección.
"Si tuviéramos tecnologías para rastrear la salud de células aisladas, tal vez podríamos diagnosticar y tratar enfermedades mucho antes y no esperar hasta que todo el órgano esté dañado", explica el líder del equipo. David Gracias en un comunicado de prensa. “Estamos hablando de poner algo así como un tatuaje electrónico en un objeto vivo decenas de veces más pequeño que la cabeza de un alfiler. Es el primer paso para conectar sensores y componentes electrónicos a células vivas”.
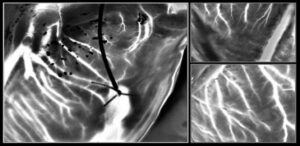
Gracias, luo gu y sus colegas han diseñado un proceso de impresión por nanotransferencia de tres etapas para unir nanopatrones de oro a células vivas. En el primer paso, utilizaron litografía de nanoimpresión (NIL) convencional para imprimir matrices de nanopuntos o nanocables de oro en obleas de silicio recubiertas de polímero. Luego disolvieron el polímero, liberando los nanoarrays para transferirlos a cubreobjetos de vidrio.
A continuación, los investigadores funcionalizaron la superficie de oro con cisteamina y recubrieron las matrices NIL de oro con una capa de transferencia de hidrogel de alginato. Demostraron que este enfoque podría transferir de manera confiable matrices de nanopuntos y nanocables de 8 × 8 mm desde el vidrio a los hidrogeles blandos y flexibles. En el paso final, las matrices NIL de oro se conjugan con gelatina para permitir su transferencia a células o tejidos vivos. Al disociar la capa de transferencia de hidrogel se expone el patrón dorado.
Los investigadores investigaron el comportamiento de células de fibroblastos vivos sembradas en matrices de puntos de oro de 250 nm de diámetro (espaciado de centro a centro de 550 nm) o alambres de oro de 300 nm de ancho (espaciado de 450 nm) sobre hidrogeles de alginato. Aproximadamente 24 h después de la siembra, las células en el hidrogel impreso con nanocables migraron preferiblemente paralelas a los nanocables, mientras que las de los nanopuntos exhibieron una migración aleatoria, pero ligeramente más rápida. Las células de los nanocables también mostraron aproximadamente el doble de alargamiento que las de los nanopuntos. Estos hallazgos demuestran la capacidad de las matrices NIL de oro para guiar la orientación y migración de las células.
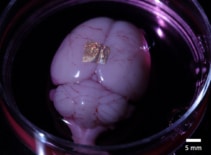
Además de ser biocompatible con células y tejidos, el hidrogel de alginato también puede transferir matrices NIL de oro a órganos y células vivos. Para demostrar esto, los investigadores colocaron hidrogeles impresos con nanocables en la corteza cerebral de un cerebro completo y en una porción coronal del cerebro.
Después de 2 h en medio de cultivo y disociación del hidrogel, los nanocables permanecieron unidos a la superficie de todo el cerebro. Por el contrario, los nanocables del corte de cerebro no se adhirieron, lo que sugiere que la fuerza de adhesión varía entre los diferentes tipos de células y métodos de cultivo. Los investigadores señalan que se necesitan más estudios para caracterizar y optimizar los mecanismos de adhesión para una unión sólida a largo plazo.
Finalmente, para evaluar la impresión por biotransferencia a nivel unicelular, los investigadores cultivaron láminas de células monocapa en hidrogeles de alginato impresos con matriz NIL de oro. Después de 24 h, voltearon los hidrogeles sembrados con fibroblastos sobre cubreobjetos recubiertos de gelatina y dejaron que las células se adhirieran a los cubreobjetos durante la noche.
Después de disociar el hidrogel de alginato, la microscopía de fluorescencia reveló que los fibroblastos modelados con nanopuntos de oro tenían una viabilidad de aproximadamente el 97 %, mientras que aquellos modelados con nanocables tenían una viabilidad de aproximadamente el 98 %, lo que indica que el proceso de impresión es biocompatible con células vivas. Los colores reflectantes que se ven en la lámina de células de fibroblastos estampada sugieren que se conservó la forma de la matriz NIL dorada.
El proceso de fabricación también es compatible con la fotolitografía a microescala, lo que permitió a los investigadores crear parches hexagonales y triangulares de 200 µm de ancho de matrices NIL de oro. Luego los imprimieron por biotransferencia en láminas de células, lo que provocó un crecimiento selectivo de células de fibroblastos en los microparches. Las películas grabadas durante 16 h mostraron que las células con parches de nanocables impresos en la parte superior parecían sanas y capaces de migrar, y las matrices permanecían en las células blandas incluso mientras se movían.

Pequeño sensor mide simultáneamente la actividad eléctrica y mecánica en las células del corazón
"Hemos demostrado que podemos unir nanopatrones complejos a células vivas, garantizando al mismo tiempo que la célula no muera", dice Gracias. "Es un resultado muy importante que las células puedan vivir y moverse con los tatuajes porque a menudo hay una incompatibilidad significativa entre las células vivas y los métodos que utilizan los ingenieros para fabricar productos electrónicos".
Gracias y sus colegas concluyen que su proceso de nanopatrones, combinado con técnicas de microfabricación estándar, "abre oportunidades para el desarrollo de nuevos sustratos de cultivo celular, materiales biohíbridos, dispositivos biónicos y biosensores". A continuación, planean intentar conectar nanocircuitos más complejos que puedan permanecer en su lugar durante períodos más largos, además de experimentar con diferentes tipos de células.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Automoción / vehículos eléctricos, Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- ChartPrime. Eleve su juego comercial con ChartPrime. Accede Aquí.
- Desplazamientos de bloque. Modernización de la propiedad de compensaciones ambientales. Accede Aquí.
- Fuente: https://physicsworld.com/a/researchers-tattoo-gold-nanopatterns-onto-live-cells/
- :posee
- :es
- :no
- $ UP
- 16
- 200
- 24
- 8
- a
- capacidad
- Poder
- Nuestra Empresa
- actividad
- adherirse
- avances
- Después
- también
- entre
- an
- y
- Aparecido
- aplicaciones
- enfoque
- aproximadamente
- somos
- en torno a
- Formación
- AS
- Asamblea
- evaluar
- At
- adjuntar
- BE
- porque
- "Ser"
- entre
- cuerpo
- bonos
- Cerebro
- pero
- PUEDEN
- Células
- caracterizar
- clic
- personal
- combinado
- compatible
- integraciones
- concluye
- contraste
- control
- convencional
- rentable
- podría
- Para crear
- Cultura
- día
- demostrar
- diseñado
- desarrollado
- Desarrollo
- Dispositivos
- HIZO
- El
- una experiencia diferente
- enfermedad
- No
- Más temprano
- Electronic
- Electrónica
- habilitar
- facilita
- certificados
- asegurando que
- Todo
- Incluso
- Explica
- más rápida
- final
- Los resultados
- Nombre
- flexible
- Desde
- promover
- GAO
- en general
- vaso
- Gold
- Crecimiento
- guía
- tenido
- Tienen
- cabeza
- Salud
- saludable
- Corazón
- Alta
- de alta resolución
- hopkins
- Sin embargo
- HTTPS
- humana
- imagen
- importante
- in
- INSTRUMENTO individual
- información
- originales
- integrar
- aislado
- IT
- johns
- La Universidad Johns Hopkins
- jpg
- .
- líder
- líder
- dejar
- Nivel
- como
- para vivir
- alga viva
- compromiso a largo plazo
- por más tiempo
- hecho
- materiales
- max-ancho
- Quizas
- medidas
- mecánico
- los mecanismos de
- Medios
- ir
- Método
- métodos
- Microscopía
- migrado
- migrado
- migración
- monitoreo
- más,
- movimiento
- emocionado
- Películas
- mucho más
- Nuevo
- Next
- objeto
- obstáculos
- of
- a menudo
- on
- ONE
- sobre
- habiertos
- Del Mañana
- Optimización
- or
- Más de
- Superar
- durante la noche
- Paralelo
- Parches
- Patrón de Costura
- períodos
- Física
- Mundo de la física
- Colocar
- plan
- Platón
- Inteligencia de datos de Platón
- PlatónDatos
- posicionado
- posible
- prensa
- Imprimir
- impresión
- en costes
- Poniendo
- azar
- RATA
- real
- en tiempo real
- grabado
- se mantuvo
- restante
- sanaciones
- Informes
- exigir
- la investigación
- investigadores
- Resolución
- resultado
- Revelado
- robusto
- aproximadamente
- dice
- visto
- selectivo
- sensor
- Forma
- hoja
- mostró
- mostrado
- importante
- Silicio
- simultáneamente
- Rebanada
- menores
- inteligente
- Soft
- algo
- estándar
- Posicionamiento
- quedarse
- paso
- fuerza
- estudios
- tal
- sugieren
- Superficie
- hablar
- equipo
- técnicas
- Tecnologías
- tener
- que
- esa
- La
- su
- luego
- Estas
- ellos
- así
- aquellos
- uña del pulgar
- equipo
- veces
- a
- parte superior
- hacia
- seguir
- transferir
- sorpresa
- verdadero
- try
- Twice
- tipos
- Finalmente, a veces
- universidad
- hasta
- utilizan el
- usado
- Aspiradora
- muy
- viabilidad
- esperar
- fue
- we
- WELL
- mientras
- que
- mientras
- todo
- amplio
- mundo
- zephyrnet