Positronemissioontomograafia (PET) on meditsiiniline pilditehnoloogia, mida kasutatakse laialdaselt nii kliinilistes kui ka prekliinilistes rakendustes. Vähiravi raames radiotracer 18F-FDG-d (fluor-18-fluorodeoksüglükoos) kasutatakse PET/CT-skaneeringutes, et tuvastada suurenenud glükoositarbimist, mis on vähirakkude tunnus. Ja teadlased on välja töötanud arvukalt täiendavaid radioaktiivseid jälgimisvahendeid, et sihtida teisi haigusspetsiifilisi markereid.
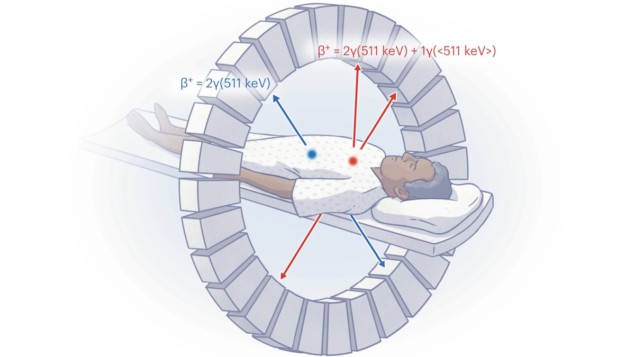
PET toimib, tuvastades kaks 511 keV annihilatsioonifootonit, mis tekivad siis, kui radiomärgise kiirgav positroni annihileerub koos elektroniga kehas. Kuna aga kõik PET-isotoobid toodavad samu kahte 511 keV footonit, on korraga võimalik pildistada ainult ühte radiomärgistikku. Signatuuride tuvastamiseks rohkem kui ühest märgistusest on vaja järjestikust PET-skaneerimist, kuid see on kulukas, sõltub sellest, kas üks märgistusaine laguneb aja jooksul piisavalt ja suurendab kaasnevate CT-skaneeringute tõttu patsiendi kiirgust.
Selle piiranguga tegelemiseks juhtis uurimisrühm Jan Grimm at Memorial Sloan Ketteringi vähikeskus ja Joaquin Herraiz at Madridi Complutense ülikool on välja töötanud uue kujutise rekonstrueerimise meetodi, mis võimaldab in vivo kahe erineva PET-märgistusaine samaaegne pildistamine. Teadlased kirjeldavad oma tehnikat, mida nimetatakse multipleksitud PET-iks (mPET). Looduse biomeditsiinitehnika.
"See edusamm võib aidata suurendada ühe skaneerimisega saavutatava molekulaarse teabe sügavust, andes nii teadlastele kui ka radioloogidele õigeaegsemat teavet diagnoosimiseks ja staadiumiks, mida ei saaks biopsiaga teha," selgitab vanemautor Grimm pressiteates. .
Kiirete gammade ärakasutamine
PET-kujutised luuakse detektoripaaride vaheliste reaktsioonijoonte (LOR) abil, mis tuvastavad kaks annihilatsioonifootonit ("topelt" sündmus) kokkulangevuse ajastusaknas umbes 3.5 ns. Mõned positrone kiirgavad isotoobid eraldavad ka täiendava kiire gammafootoni. Kui see avastatakse kokkusattumuste aknas, põhjustab see "kolmekordse" sündmuse, mida tavaliselt peetakse võltsiks ja mida ei rekonstrueerita. Sageli välditakse selliseid isotoope meditsiinilistel skaneeringutel.
Aga esimene autor Edwin Pratt ja kolleegid on näidanud, kuidas seda kiiret gammakiirgust kasutada kahe radiomärgise eristamiseks PET-skaneerimisel. Suurendades kokkulangevuse energiaakna, et see hõlmaks kiiret gammakiirgust, ja töötades välja meetodi topeltkokkusattumuste eraldamiseks ja rekonstrueerimiseks kolmekordsetest kokkusattumustest, saavad nad iga PET-skaneerimise jaoks luua kaks eraldi andmekogumit.
Neid andmekogumeid saab kasutada kahe samaaegselt manustatud PET-radiomärgistusaine kvantitatiivsete kujutiste saamiseks, millel on sarnane jõudlus kahe eraldi hankimisega. "Kasutades sobivat radiomärgistuspaari (üks sisaldab standardset positrone kiirgavat isotoopi ja teine isotoopi, mis kiirgab ka kiiret gammat) ja õiget kujutise rekonstrueerimismeetodit (mPET), on võimalik saavutada tõelise samaaegse kahe isotoobiga PET-pildistamine enamikus praegused PET-skannerid, ilma muudatusteta või energiapõhise diskrimineerimise vajaduseta, ”ütleb kaasautor Herraiz.
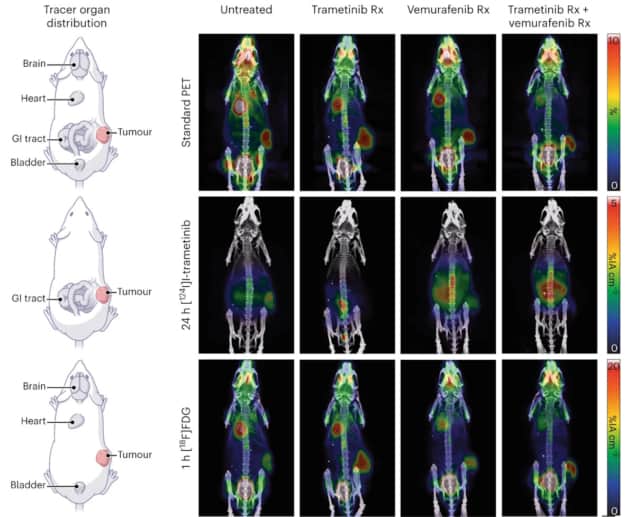
Teadlased testisid esmalt oma mPET-meetodi teostatavust prekliinilises ja kliinilises PET-skanneris. Nad kujutasid fantoome, mis sisaldasid topeltkiirgavat isotoopi tsirkoonium-89 (89Zr) ja kolmekordselt kiirgav jood-124 (124I). Nad leidsid, et mõlemad süsteemid võivad hankida mPET-i eraldamiseks sobivaid andmeid ja et mPET-i rekonstrueerimismeetod võib luua kaks samaaegset isotoobipilti. Seejärel kolisid nad elama in vivo prekliinilised katsed.
Melanoomi kasvajatega hiirtel kasutasid teadlased mPET-i, et jälgida kahe süstitud radiomärgise biojaotust: 124I-trametiniib, mis on suunatud vohavatele kudedele; ja 18F-FDG, mis on suunatud glükoosi aktiivsusele. Kahekordse ja kolmekordse sündmuse eraldamisel täheldasid nad kahe märgistusaine kahte erinevat bioloogilist jaotumist. Nad kujutasid ka hiiri, kes said erinevaid ravimteraapiaid, jälgides, et mPET-ga kahekordset kujutist saab kasutada ravimite mõju jälgimiseks kasvajale, säilitades samal ajal standardse FDG-PET-pildi.
Ravimi kohaletoimetamise jälgimine
Nanoosakesi kasutatakse laialdaselt ravimikandjatena ja ravimite bioloogilist jaotumist muutvate ainetena, mis ideaaljuhul vähendavad sihtmärgist väljumist. Sageli hinnatakse sellist ravimi kohaletoimetamist radioaktiivselt märgistatud nanoosakeste jälgimise teel ja eeldades, et ravimi jaotus on sama. Kuid see ei pruugi alati nii olla. Selle edasiseks uurimiseks kasutasid Pratt ja tema kolleegid mPET-i, et mitteinvasiivselt jälgida ja kvantifitseerida radioaktiivselt märgistatud ravimit ja nanoosakesi eraldi.
Meeskond, mida haldas 89Zr-ferumoksütooli nanoosakesed, mis on laetud vähiravimiga 124I-trametiniib melanoomi kandvale hiirele. MPET-i kasutamine signaalide eraldamiseks ravimist ja nanoosakestest näitas, et varsti pärast süstimist ei vastanud ravimi jaotus kandja nanoosakese omale. See leid viitab sellele, et ootamatult oli suurem osa ravimist kiiresti dissotsieerunud in vivo, mis näitab selle uue tehnika väärtuslikku rakendust.
Teadlased kasutasid ka mPET-i immunoteraapias kasutatavate CAR T-rakkude jälgimiseks eesnäärme-spetsiifilise membraani antigeeni (PSMA) positiivsete kasvajate sihtimiseks. PSMA-positiivse kasvajaga hiirtel kasutasid nad 124I visualiseerida CAR T-rakkude ja gallium-68 jaotust (68Ga)-PSMA-11, et mõõta samaaegselt PSMA-positiivse kasvaja asukohta ja ekspressiooni.
mPET-i võime eraldada kaks radioaktiivset märgist näitas, et nende jaotus oli erinev 68Ga-PSMA-11 kasvajas, neerudes ja põies, samas 124Mind leiti kasvajast, kilpnäärmest, neerudest, maost ja põiest. Kasvaja läbivad aksiaalsed viilud näitasid kahe märgistusaine erinevat intratumoraalset jaotust. mPET-i rekonstrueerimine andis võimaluse jälgida CAR T-rakkude sihtimist, kinnitades samal ajal PSMA ekspressiooni sama PET-skaneerimise ajal.

Kompaktne kiirgusdetektor võib kiirendada dünaamilise PET-i kasutamist
Uurijad järeldavad, et mPET annab lisateavet teise märgistusaine lisamise kaudu, kasutades ära paljusid isotoope, mida varem peeti nende täiendavate gammaheitmete tõttu problemaatiliseks. Nad rõhutavad, et mPET-i saab rakendada nii prekliinilistes kui ka kliinilistes PET / CT süsteemides ilma riistvara või kujutise hankimise tarkvara muutmiseta. "Ilus on see, et mPET on koheselt kliiniliselt tõlgitav," ütleb Pratt. "Seda lähenemisviisi saab teha enamiku olemasolevate masinatega minimaalsete muudatustega."
Järgmine samm on mPET-i rakendamine erinevatele uuringutele, ütlevad teadlased Füüsika maailm. See hõlmab mPET-i kasutamist vähiravi suhtes resistentsuse tuvastamiseks, selle hindamist teiste positroni-gamma-kiirguse tekitajatega, selle võimaluste laiendamist enam kui kahe isotoobi üheaegseks kuvamiseks ja selle testimist kliinikus õiges keskkonnas patsientidega.
- SEO-põhise sisu ja PR-levi. Võimenduge juba täna.
- PlatoData.Network Vertikaalne generatiivne Ai. Jõustage ennast. Juurdepääs siia.
- PlatoAiStream. Web3 luure. Täiustatud teadmised. Juurdepääs siia.
- PlatoESG. Autod/elektrisõidukid, Süsinik, CleanTech, Energia, Keskkond päikeseenergia, Jäätmekäitluse. Juurdepääs siia.
- BlockOffsets. Keskkonnakompensatsiooni omandi ajakohastamine. Juurdepääs siia.
- Allikas: https://physicsworld.com/a/multiplexed-pet-can-image-two-radiotracers-in-a-single-scan/
- :on
- :on
- :mitte
- $ UP
- 10
- a
- võime
- MEIST
- saavutada
- omandama
- omandamine
- ülevõtmised
- tegevus
- lisamine
- Täiendavad lisad
- Tooteinfo
- manustatud
- edendama
- pärast
- ained
- AL
- sama
- Materjal: BPA ja flataatide vaba plastik
- Ka
- alati
- an
- ja
- mistahes
- taotlus
- rakendused
- kehtima
- lähenemine
- OLEME
- AS
- hinnatud
- At
- Saavutatav
- autor
- vältida
- BE
- Ilu
- sest
- vahel
- biomeditsiiniline
- keha
- mõlemad
- kuid
- by
- kutsutud
- CAN
- vähk
- Vähirakud
- võimeid
- auto
- mis
- vedajad
- juhul
- Rakke
- selgelt
- klõps
- kliinik
- kliiniline
- juhus
- kolleegidega
- lõpetama
- kaaluda
- kulukas
- võiks
- looma
- loodud
- Praegune
- andmed
- andmekogumid
- tarne
- näidates
- sõltub
- sügavus
- kirjeldama
- avastama
- tuvastatud
- arenenud
- arenev
- DID
- erinev
- eristatav
- eristama
- jaotus
- Väljamaksed
- tehtud
- kahekordistada
- uimasti
- kaks
- ajal
- dünaamiline
- e
- iga
- mõju
- emissioon
- Heitkoguste
- rõhuta
- töötavad
- võimaldab
- energia
- hindamine
- sündmus
- sündmused
- olemasolevate
- kiirendada
- katseid
- Selgitab
- ära kasutades
- Säritus
- väljend
- laiendades
- leidmine
- esimene
- eest
- avastatud
- Alates
- edasi
- tekitama
- annab
- andmine
- olnud
- riistvara
- Olema
- pealkirjastatud
- aitama
- Kuidas
- Kuidas
- aga
- HTTPS
- ideaalis
- identifitseerima
- if
- pilt
- pildid
- Imaging
- kohe
- immuunravi
- rakendatud
- in
- sisaldama
- hõlmab
- Suurendama
- kasvanud
- Tõstab
- kasvav
- info
- uurima
- probleem
- IT
- ITS
- jpg
- piiramine
- liinid
- liising
- Langetamine
- masinad
- säilitamine
- palju
- Vastama
- max laiuse
- mai..
- mõõtma
- meditsiini-
- meetod
- minimaalne
- Muudatused
- molekulaarne
- Jälgida
- rohkem
- kõige
- kolis
- loodus
- Vajadus
- Uus
- järgmine
- arvukad
- of
- sageli
- on
- ONE
- ainult
- avatud
- or
- Muu
- üle
- ülevaade
- paar
- paari
- patsientidel
- jõudlus
- Footonid
- Füüsika
- Füüsika maailm
- Platon
- Platoni andmete intelligentsus
- PlatoData
- võimalik
- vajutage
- varem
- tootma
- korralik
- tingimusel
- annab
- kvantitatiivne
- kiiresti
- vastuvõtmine
- Vajab
- teadustöö
- Teadlased
- Vastupidavus
- vastus
- Revealed
- õige
- Tõusma
- sama
- ütleb
- skaneerida
- skaneerimine
- teadlased
- Teine
- nähtud
- eri
- eraldamine
- kehtestamine
- näitama
- näitas
- näidatud
- signaale
- Allkirjad
- sarnane
- üheaegselt
- ühekordne
- Sloan
- tarkvara
- mõned
- varsti
- matkimine
- standard
- väljavõte
- Samm
- uuringud
- selline
- Soovitab
- sobiv
- süsteemid
- sihtmärk
- sihtimine
- eesmärgid
- meeskond
- Tehnoloogia
- öelda
- katsetatud
- Testimine
- kui
- et
- .
- oma
- SIIS
- Seal.
- nad
- see
- Läbi
- thumbnail
- aeg
- et
- viik
- jälgida
- Jälgimine
- Kolmekordne
- tõsi
- kaks
- toimumas
- Ülikool
- peale
- kasutama
- Kasutatud
- kasutamine
- tavaliselt
- väärtuslik
- eri
- kaudu
- oli
- Tee..
- olid
- millal
- mis
- kuigi
- laialdaselt
- will
- aken
- koos
- jooksul
- ilma
- töötab
- maailm
- sephyrnet