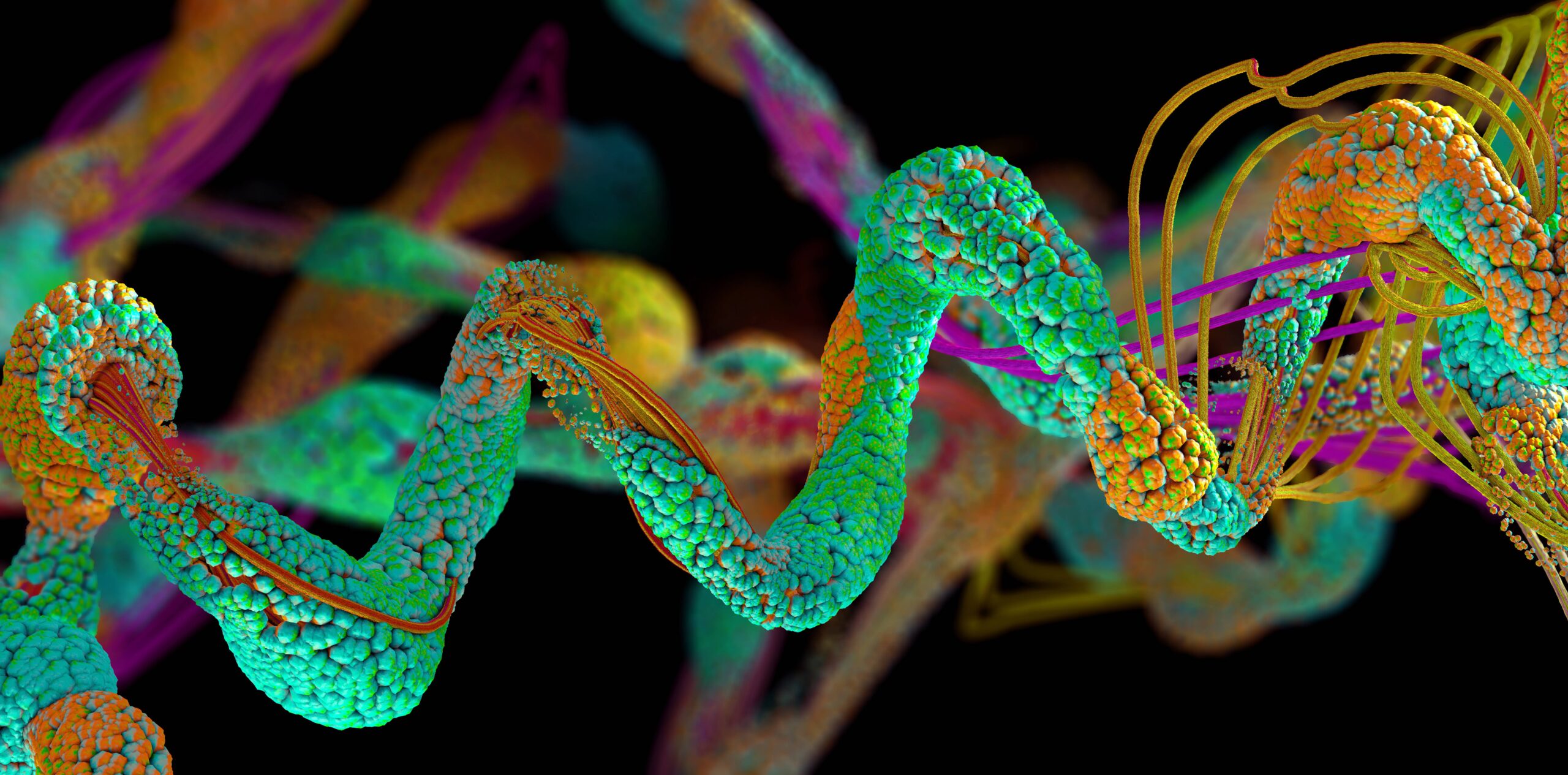
Tehisintellektiga töötav valkude voltimismudel AlphaFold on ennustanud enam kui 200 miljonit valku, mis on peaaegu kõik sellised teadusele teadaolevad struktuurid, teatas DeepMind neljapäeval.
Valgud on keerulised bioloogilised molekulid, mida toodetakse elusorganismides DNA-s talletatud juhiste järgi. Need nanomõõtmelised ahelad, mis on valmistatud kuni 20 tüüpi aminohapetest, täidavad elutähtsaid rakulisi ülesandeid, et täita kõikvõimalikke kehafunktsioone. Valkude kolmemõõtmelise vormi tundmine on oluline, kuna selle füüsiline struktuur annab vihjeid selle kohta, kuidas see käitub ja millist eesmärki see teenib, mis aitab meil teha selliseid asju nagu ravimeid välja töötada ja luua koopiavalke neile, kellel neid puuduvad.
Mõned valgud on kasulikud, näiteks need, mis on seotud toidu seedimisega, samas kui teised võivad olla kahjulikud, näiteks need, mis on seotud kasvajate kasvuga. Nende keeruliste vingerdavate kujundite väljaselgitamine on aga keeruline. Molekulaarbioloogid võivad kulutada aastaid katseid tehes valgu struktuuri dešifreerimiseks ja AlphaFold suudab seda aminohapete koostise põhjal teha minutitega, olenevalt molekuli suurusest.
AlphaFoldi koolitati sadade tuhandete teadaolevate valgustruktuuride alal ning ta õppis seoseid koostisosade aminohapete ja lõplike üldkujude vahel. Arvestades suvalise sisestatud aminohappejärjestust, suudab mudel ennustada 3D-valgu struktuuri. Nüüd on mudel ennustanud peaaegu kõiki teadusele teadaolevaid valgu struktuure.
Koostöös Euroopa Bioinformaatika Instituudiga on DeepMind oma tegevust laiendanud AlphaFoldi valgu struktuuri andmebaas sisaldama enam kui 200 miljonit 3D-kujulist valku loomadest taimeni, bakteritest viirusteni – see on enam kui 200-kordne kasv peaaegu miljonilt molekulilt vähemalt 200 miljonile molekulile vaid aastaga.
"Lootsime, et see murranguline ressurss aitab kiirendada teadusuuringuid ja avastusi kogu maailmas ning et teised meeskonnad saaksid õppida AlphaFoldiga tehtud edusammudest ja nendele tugineda, et luua edasisi läbimurdeid," Demis Hassibis, DeepMindi kaasasutaja ja tegevjuht ütles neljapäeval avalduses.
"See lootus on saanud reaalsuseks palju kiiremini, kui olime julgenud unistada. Vaid kaksteist kuud hiljem on AlphaFoldile ligi pääsenud enam kui pool miljonit teadlast ja seda on kasutatud oluliste reaalsete probleemide lahendamise kiirendamiseks, alates plastireostusest kuni antibiootikumiresistentsuseni.
Register on küsinud DeepMindilt lisakommentaari.
AlphaFold on näidanud ka suurt potentsiaali uute ravimite väljatöötamiseks. Need struktuurid aitavad teadlastel välja selgitada keemilised ühendid, mis võivad sihtvalkudega seonduda, et ravida või takistada nende patoloogiliste funktsioonide täitmist. Ettevõtted, sealhulgas Insilco Medicine, on katsetanud koos mudeliga uute ravimite avastamiseks; ütles tegevjuht Alex Žavoronkov Register et protsess on palju keerulisem, kui arvate, ja hõlmab mitut etappi.
Pole selge, kui täpsed on AlphaFoldi ennustused. Valgu linditaoline struktuur muudab sageli kuju, kui see suhtleb ravimiga. AlphaFold ei saa teadlasi aidata, kuna tal pole selleks väljaõpet. Žavoronkov ütles, et mudel on "üsna märkimisväärne läbimurre", kuid oli kogu reklaami suhtes ettevaatlik.
"Kuni me näeme AlphaFoldi abil ilma täiendavate katseteta saadud suure haiguse uudse sihtmärgi struktuuri, AI- või muude meetodite abil loodud molekuli, kasutades seda ennustatud struktuuri, sünteesiti ja testiti kogu tee ning avaldati seejärel kõrges ajakirjas. – [saame] siis tähistada.
Big Pharma soovib näha AI-tööriistade, nagu AlphaFold, abil loodud molekule, mida testitakse tegelikult hiirtel ja inimestel. "Puhtalgoritmilised saavutused ei ole farmaatsiaettevõtetele ja eriti patsientidele väärtuslikud," lisas Žavoronkov.
Haruldaste geneetiliste haiguste raviks kasutatavate ravimite väljatöötamiseks masinõppe algoritme kasutava idufirma Collaboration Pharmaceuticalsi vanemteadur Fabio Urbina ütles, et AlphaFold ei ole veel tema uurimistöös kasulikuks osutunud. Urbina kasutab teistsugust tehnikat ja keskendub rohkem potentsiaalse uue ravimi struktuurile, mitte sihtvalgule.
Veel ei ole näha, kas valgustruktuurid on piisavalt kasulikud, et aidata meil avastada uusi potentsiaalseid ravimeid haruldaste haiguste raviks
„See on mõnel põhjusel; Paljude ravimite sihtmärkide valgustruktuurid ei olnud teadlastele sageli kasutamiseks hõlpsasti kättesaadavad ja valguteave ei aidanud varajastel masinõppemudelitel oma ennustusvõimet oluliselt parandada, ”rääkis ta. Register.
"Olen ettevaatlikult optimistlik, et AlphaFold on sisuliselt esimese probleemi lahendanud, kuid pole veel näha, kas valgustruktuurid on piisavalt kasulikud meie masinõppe ennustamisvõime parandamiseks, et aidata meil avastada uusi potentsiaalseid ravimeid. haruldaste haiguste puhul. Siiski oleme üha enam näinud, et valgu struktuuriteavet võetakse arvesse uuemate masinõppemeetodite osana ja oleme mõelnud sama teha.
Peaaegu kõigi teadaolevate valgustruktuuridega andmebaasi kättesaadavaks tegemine, nagu DeepMind on lubanud, tähendab, et rohkematel teadlastel on ressursse katsetamiseks ja võimsamate AI-mudelite ehitamiseks, ütles Urbina. "Olen ettevaatlikult optimistlik, kuid kuna saadaval on kogu valgustruktuuride raamatukogu, siis ma ütleksin, et on hea võimalus, et AlphaFoldi struktuurid lisatakse mõnesse meie masinõppe mudelisse ja võivad lõpuks aidata meil avastada uusi ravimeetodeid. ” ®
- AI
- ai kunst
- ai kunsti generaator
- on robot
- tehisintellekti
- tehisintellekti sertifikaat
- tehisintellekt panganduses
- tehisintellekti robot
- tehisintellekti robotid
- tehisintellekti tarkvara
- blockchain
- plokiahela konverents ai
- coingenius
- vestluslik tehisintellekt
- krüptokonverents ai
- dall's
- sügav õpe
- google ai
- masinõpe
- Platon
- plato ai
- Platoni andmete intelligentsus
- Platoni mäng
- PlatoData
- platogaming
- skaala ai
- süntaks
- Register
- sephyrnet