Viiruste sees olev geneetiline materjal ei suuda kaua püsida ilma valkudest kaitsva katteta. Kuid protsess, mille käigus need valgud viiruse genoomi kapseldamiseks (ja seega kaitsmiseks) kogunevad, pole hästi mõistetav – eriti koroonaviiruste puhul, millel on väga suured RNA genoomid. USA Riverside'i California ülikooli ja Hiina Songshan Lake Materials Laboratory teadlaste paar on nüüd tuvastanud COVID-2 põhjustava koroonaviiruse SARS-CoV-19 koostamisel esinevad vastasmõjud ja uurinud, kuidas need vastasmõjud. viia genoom pakendamiseni uude virioni. Töö võib aidata selle ja teiste koroonaviiruste vastu võitlemiseks mõeldud ravimite väljatöötamisel ja arendamisel.
SARS-CoV-2 sisaldab nelja struktuurset valku: ümbris (E); membraan (M); nukleokapsiid (N); ja teravik (S). M-, E- ja S-valgud on üliolulised viiruse kõige välimise kihi ehk ümbrise kokkupanemiseks ja moodustamiseks, mis aitab viirusel peremeesrakkudesse siseneda ja kaitseb seda kahjustuste eest.
Kompaktne ribonukleoproteiini kompleks
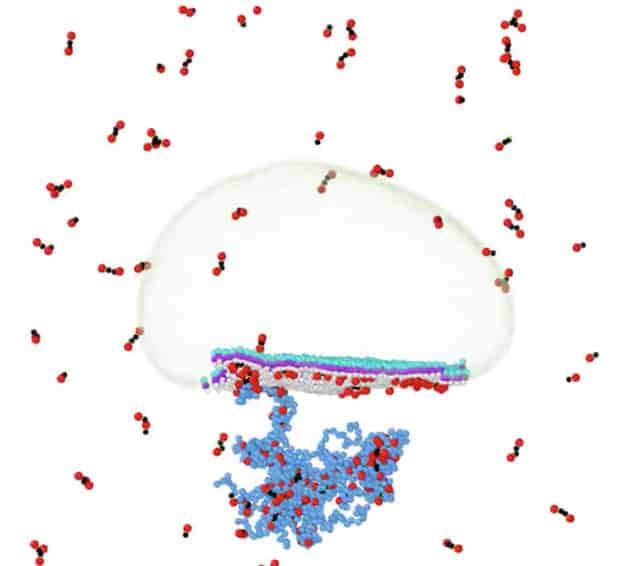
Uues töös UC-Riverside füüsik Roya Zandi ja tema endine magistrant Siyu Li (kes on praegu Songhan Lake'i järeldoktor) kasutas jämedateraliste mudelitena tuntud arvutustööriistu, et simuleerida SARS-CoV-2 moodustumist nendest koostisosadest. Need mudelid jäljendavad viiruse komponente suures pikkuses ja pakuvad väärtuslikku teavet viiruse kogumisprotsesside kohta.
Neid mudeleid kasutades arvutas paar välja, et N-valgud kondenseerivad viiruse RNA, moodustades nn kompaktse ribonukleoproteiinikompleksi, mis kujutab endast nii valgust kui ka RNA-st koosnevate molekulide kogumit. Seejärel interakteerub see koost lipiidmembraani põimitud M-valkudega. Lõpuks toimub protsess, mida nimetatakse ribonukleoproteiini kompleksi "pungamiseks", mis viib viiruse moodustumise lõpule.
N-valkude vaheline interaktsioon on väga oluline
Teadlased võtsid oma mudelis N-valgu kuju aluseks kirjanduses kirjeldatud hästi tuntud struktuuri. "RNA on negatiivselt laetud polümeer ja N-valkudes on palju positiivseid laenguid, " selgitab Zandi. "N-valkude positiivsete laengute ja RNA negatiivsete laengute vastastikmõju põhjustab RNA kondenseerumist."
Zandi jutustab Füüsika maailm et N-valkude vahelised interaktsioonid osutusid RNA kondenseerumisel väga oluliseks. "Me ei teadnud sellest efektist enne oma simulatsioonide läbiviimist, " lisab ta.
Paar modelleeris ka M-valke nende struktuuri ja funktsiooni põhjal, nagu on kirjeldatud kirjanduses. Nad kujundasid need valgud nii, et need interakteeruvad N-valkudega ja painutavad ka membraani. "Jämedateraline mudel on võimaldanud meil mõista valkude oligomerisatsiooni mehhanisme, RNA kondenseerumist struktuursete valkude poolt ja membraani-valgu interaktsioone, ennustades tegureid, mis kontrollivad viiruse kokkupanekut, " selgitab Li.

Üliresolutsiooniga mikroskoopia paljastab koroonaviirust paljundava mehhanismi
Varem märgib Zandi, et viiruse kogunemist soodustavate tegurite mõistmine on sageli viinud uute ravistrateegiateni. Tema arvates on selle uuringu tulemused, mis on ajakirjas üksikasjalikult kirjeldatud Viirused, võiks samuti aidata pakkuda vahendeid SARS-CoV-2 vastu võitlemiseks. "Meie avastatud montaažimehhanism võib anda teavet väikeste molekulide kavandamisel ja arendamisel, mis on suunatud viiruse struktuuri valkudele, muutes nende funktsioone, et häirida montaažiprotsessi täpsust, " ütleb ta.
Pikemas perspektiivis arvab Zandi, et uus töö võib isegi saada katsete ja mikroskoopiliste kõigi aatomite simulatsioonide võrdlusaluseks. "Teeme praegu koostööd eksperimentaalsete ja arvutusrühmadega meie uurimiste järgmise etapi jaoks, " paljastab ta. "Lõppkokkuvõttes on meie eesmärk ühendada mitmetasandilised uuringud, et edendada viirusevastaste ravimite jätkuvat arendamist, et peatada koroonaviirused nende kokkupanemisetapis."