Prootonteraapia võib viia kasvaja sihtmärgile väga konformse annuse jaotuse, minimeerides samal ajal doosi sihtmahust väljapoole jäävatele kudedele. Seda tugevust realiseerivate raviplaanide koostamine on dosimeetrite ja meditsiinifüüsikute jaoks esmatähtis.
Prootonid ladestavad doosi põhimõtteliselt erineval viisil kui röntgenikiirgus, teist tüüpi välise kiiritusravi. Kui prooton jõuab oma trajektoori lõppu, suureneb tema energia kudedesse ülekandmise kiirus – lineaarne energiaülekanne (LET), väljendatuna keV/µm.
Suhteline bioloogiline efektiivsus (RBE) kajastab LET suurenemise bioloogilisi mõjusid ja kliinilise prootonravi puhul kasutatakse sageli fikseeritud RBE väärtust 1.1, XNUMX. Kuid prootoni RBE sõltub paljudest muudest teguritest, sealhulgas kliinilistest tulemusnäitajatest, koetüübist, fraktsioneerimisskeemist, patsiendi spetsiifilisest radiosensitiivsusest, füüsilisest doosist ja eksperimentaalsete mõõtmiste määramatusest. Selle tulemusena alahindab prootonteraapias fikseeritud RBE väärtuse kasutamine tõenäoliselt RBE-d kõrge LET-i asukohtades, mis võib suurendada kiirgusest põhjustatud toksilisuse riski.
Siiski on LET tugevas korrelatsioonis RBE-ga ja on võtmetegur muutuva RBE määramisel prootonteraapias. Sellisena uurivad teadlased lähenemisviise LET arvutamiseks ja hindamiseks ravi planeerimise ajal. Need bioloogilise ravi planeerimise vahendid on aga piiratud ja kuni neid edasi arendatakse ja edasi uuritakse, peavad kliinikud kindlaks määrama oma ravi planeerimise tavad, et minimeerida LET-i väljaspool sihtmahtu, ütleb. Austin Faught, meditsiinifüüsik aadressil St Jude laste uurimishaigla Tennessees.
"Kuidas [LET-jaotust] mõjutada, on aktiivne uurimisvaldkond ja väljatöötamisel on mõned suurepärased meetodid, " selgitab Faught. "Probleem, millega me silmitsi seisame, on see, et need ei ole hõlpsasti kättesaadavad ilma ettevõttesiseselt välja töötatud kohandatud tarkvarata või müüja pakutavate rakenduste spetsiaalsete uurimisversioonideta … [ja on vähe uuringuid, mis annavad kvantitatiivseid juhiseid selle kohta, mida peaksime püüdma."
Ravi planeerimise strateegiad
LET-põhise fotoonteraapia plaani hindamise ja optimeerimise poole liikudes viisid Faught ja tema meeskond läbi uuringu planeerimisstrateegiate kohta, mis on kliinilistele meeskondadele kaubanduslikult kättesaadavad intensiivsusega moduleeritud prootonteraapia (IMPT) jaoks. Nende uuring, millest teatati Journal of Applied Clinical Medical Physics, tutvustab mõningaid juhiseid prootonteraapia ravi planeerijatele. "Tahtsime uurida mõnda hõlpsasti kättesaadavat ravi planeerimise tehnikat ja seda, kuidas need võivad LET-i mõjutada, " selgitab Faught.
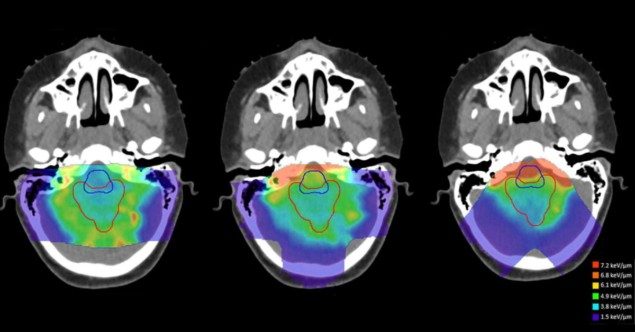
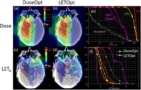
Teadlased hindasid erinevusi annusega kaalutud LET-is (LETd) kaheksa silindrilise veefantoomi ja nelja laste ajukasvaja juhtumi puhul rakendatud edasise ravi planeerimise lähenemisviisi vahel (Faught märgib, et kiirgusest põhjustatud toksilisus on töörühma fookusvaldkond). Nad võrdlesid neid planeerimisstrateegiaid plaaniga, mis kasutas vastandlikke külgmisi kiirte (fantoomi jaoks) või esialgse kliinilise plaaniga (patsientide jaoks), kasutades Monte Carlo sekundaarseid arvutusi nii annuse kui ka LET-i hindamiseks.d.
Uurijad leidsid, et raviväljade geomeetria oli kõige suurem panus kõrge LET-i piirkondade paiknemisse. Kõrge LET-ga seotud bioloogilise ebakindluse võimaliku mõju leevendamiseksd, viitavad nad sellele, et raviplaneerijad kasutavad ravikiirte vahel suuri ristumisnurki ja väldivad kiirte, mis peatuvad vahetult kriitiliste struktuuride läheduses.
"See on suurepärane uudis, kuna see tähendab, et raviväljade arvu hoolikas valimine ja nende orientatsioon lähedal asuvate tervisekudede suhtes võib olla tõhus," ütleb Faught. "Teadliku ja ettenägeliku mõttega saavad kõik raviplaneerijad seda planeerimisprotsessis arvesse võtta."
Teadlased leidsid ka, et vahemiku nihuti kasutamine vähendas oluliselt keskmist LET-id kliinilises sihtmahus. Seetõttu soovitavad nad kasutada vahemiku nihutajaid ja alternatiivseid kohtade paigutuse piirangute strateegiaid säästlikult ja ainult siis, kui kliinikud saavad arvutada saadud LET-i.d alternatiivsete planeerimisstrateegiate alusel.
Uuringu väikese valimi tõttu ei suutnud teadlased LET-is selget suundumust kindlaks tehad variatsioonid kliinilistes juhtumites. Nad ei hinnanud seost LET-i muutuste ja kasvaja kontrolli või normaalse koe tüsistuste tõenäosuse muutumise vahel.
LET-põhised plaanid optimeerivad prootonteraapiat
Kuigi iga planeerimisviisi mõju kõrge LET-i piirkondadele oli tagasihoidlik, on Faught sõnul oluline mõista, et meeskonna ravi planeerimise strateegiad ja soovitused on tõenduspõhised ja neid saab hõlpsasti kliinilises praktikas rakendada.
„Loodan, et üks võte on see, et meile kui valdkonnale oleks kasu kommertstööriistadest, mis võimaldavad ravi planeerimise süsteemi raames LET-i arvutada. Veelgi parem, me sooviksime, et meil oleks võimalusi optimeerimiseks LET-i silmas pidades. See uuring oli hea sild, kuni need tööriistad on laiemalt kättesaadavad, " ütleb Faught.