Osakeste teraapia – vähiravi prootonite või raskemate ioonide kiirte abil – tagab väga konformse doosi kohaletoimetamise ja normaalsete kudede suurema säästmise kui tavaline footonipõhine kiiritusravi. Kuid pikaajaliste vähi üleelajate jaoks on kiirgusest põhjustatud sekundaarse vähi (SC) risk oluline ja seda tuleks raviviisi valimisel arvestada.
Kuna epidemioloogilisi andmeid uuemate ravimeetodite (nt prooton- ja süsinik-ioonteraapia) kohta napib, asus meeskond GSI Helmholtzi raskete ioonide uurimise keskus töötab välja mudeli, et võrrelda SC riske osakeste teraapia meetodite vahel. Mudel, mida kirjeldas Antonia Hufnagl ja kolleegid sisse Meditsiiniline füüsika, võiks lõpuks lisada ravi planeerimise süsteemidesse, et hõlmata SC-risk täiendava optimeerimiskriteeriumina.
Surmavad versus kantserogeensed sündmused
SC riskimudelid töötavad tavaliselt, võttes arvesse rakkude tapmise (viib vähi supressiooni) ja raku transformatsiooni (mutatsioonide esilekutsumine, mis lõpuks põhjustavad vähki) vahel. Tõenäosus, et kiiritatud mahus vähk areneb, määratakse lineaar-kvadraatilise (LQ) mudeli abil, mis annab lihtsa seose rakkude ellujäämise ja manustatud footoni annuse vahel.
Selles uuringus kasutasid teadlased kohaliku efekti mudelit (LEM), et ennustada SC induktsiooni suhtelist bioloogilist efektiivsust (RBE) pärast osakeste ravi. Osakeste kiirguse suurenenud RBE arvessevõtmiseks asendasid nad riskimudeli footoni LQ parameetrid LEM-i ennustatud ioonkiire LQ parameetritega. Nende lähenemisviisi põhijooneks on LEM-i kasutamine nii rakkude tapmise kui ka vähi esilekutsumise terminites.

"LEM-i kahekordne kasutamine peegeldab konkurentsi kahe peamise protsessi vahel, mis määravad SC arengut, nimelt rakkude transformatsiooni ja rakkude tapmise, " selgitab vanem autor. Michael Scholz. "Kasvava annuse ja/või tõhususe korral võib rakkude tapmine suruda alla transformeeritud rakkude elujõulisust. See toob kaasa keeruka koosmõju, mida ei saa lihtsalt muul viisil üheetapilises menetluses kajastada.
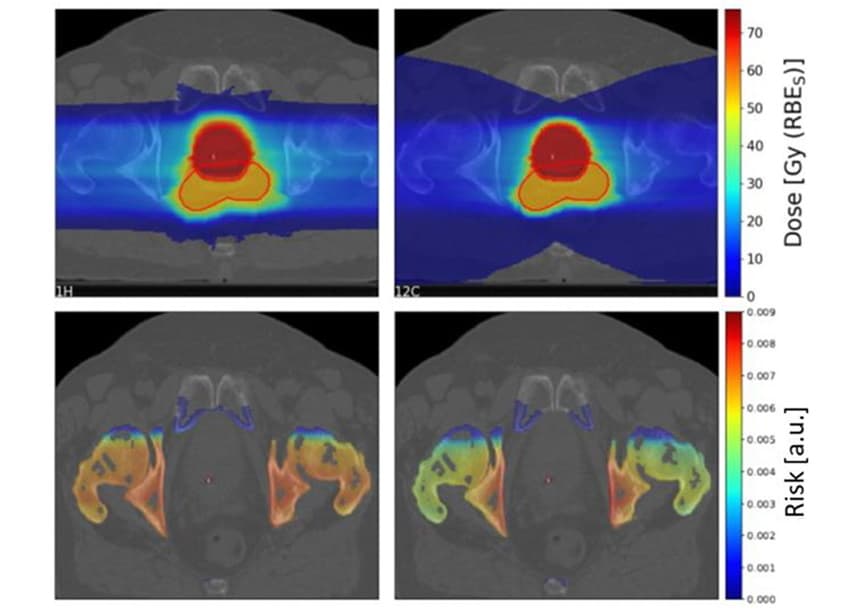
Uurimaks, millised tegurid mõjutavad SC riski, kasutasid teadlased TPS TRIP98 planeerimissüsteemi, et luua idealiseeritud geomeetria alusel bioloogiliselt optimeeritud süsiniku-ioonide ja prootonite töötlemiskavad. Plaanid kiiritasid 4x4x4 cm sihtmärki ühe osakeste kiirega või kahe vastassuunalise kiirga, kusjuures sihtmärgi ees oli 4x4x1 cm suurune riskiorgan (OAR). LEM-i sisendina kasutatud footoni LQ parameetrite ebakindluse tõttu hindasid nad prootoni-süsiniku ioonide riskisuhteid, mitte individuaalseid riskiväärtusi.
Nende idealiseeritud seadistuste puhul ei näidanud mudel selget eelistust ei prootonite ega süsiniku ioonide suhtes, kuid näitas keerulist sõltuvust erinevatest parameetritest. Süsinikuioonide vähenenud külgne hajumine toob kaasa väiksema SC riski kui prootonid sissepääsukanalis. Kuid süsinikuioonid ladestavad killustatuse tõttu sihtmärgi taha suurema annuse, suurendades pärast süsinikuioonide kiiritamist kasvaja taga olevate OAR-ide riski.
Ühekiireliste plaanide puhul oli SC kogurisk süsinikuioonide puhul ligikaudu 1.5 korda suurem kui prootonite puhul. Kahe vastassuunalise kiire korral oli SC kogurisk prootonite puhul 1.16, XNUMX korda suurem, kuigi see varieerus tugevalt sõltuvalt eeldatava tundliku ruumala ruumilisest asukohast sihtmahu suhtes.
Kudede kiirgustundlikkus (footonite suhtes) avaldas suurt mõju SC riskisuhtele, kusjuures radioresistentsed OAR-id said kasu süsinikioontöötlusest ja tundlikud OAR-id prootonkiirtest. Seevastu fraktsioneerimisskeem mõjutas eeldatavaid riskiväärtusi vähe.
Patsiendi geomeetria
Kliiniliste stsenaariumide uurimiseks hindasid Scholz ja kolleegid SC riske 10 eesnäärmevähiga patsiendil, keda varem raviti Karolinska ülikooli haiglas fotoonkiirgusega. Nad koostasid patsientide jaoks raviplaanid, kasutades kahte külgsuunas vastandlikku skaneeritud prootoni- ja süsinik-ioonivälja.
Nagu varem näha, põhjustas süsinikuioonide killustumise saba sihtmärgi taga suure väikese doosiga ala. Suure annuse sihtpiirkond oli aga süsiniku ioonide jaoks konformsem kui prootoniplaanid.
Meeskond arvutas 10 patsiendi nelja OAR-i (põie, pärasoole, luude ja naha) prootoni-süsiniku ioonide SC riskisuhted. Luu ja naha puhul andsid prootoniplaanid veidi kõrgema SC riski kui süsiniku ioonide plaanid, luude ja naha riskide mediaansuhted olid vastavalt 1.19 ja 1.06. Kusepõie ja pärasoole puhul andsid prootoniplaanid aga oluliselt väiksemad SC riskid, põie ja pärasoole riskisuhted olid vastavalt 0.68 ja 0.49.
Teadlased järeldavad, et selle mudeli abil saadud arusaamad võivad aidata tulevasi ravimeetodeid optimeerida. Praegu sobib suhtelise riski modelleerimine peamiselt erinevate patsiendirühmade ravistsenaariumide võrdlemise vahendina. Kuid Scholz märgib, et selliste mudelite kaasamine üksikute patsientide raviplaanidesse oleks lihtne.

Süsinikuioonide võreteraapia säästab terveid kudesid
"See nõuab lihtsalt etteantud annuse jaotuse planeerimist kahe erineva bioloogilise parameetri komplektiga, mis esindavad vastavalt rakkude tapmist ja raku transformatsiooni protsessi, " selgitab ta. "Seejärel on vastavate riskisuhtejaotuste tuletamiseks vaja ainult mõningast järeltöötlust saadud 3D-efektide jaotuste jaoks standardsete matemaatiliste tööriistadega."
Tema sõnul on järgmine samm mudeli kinnitamine kliiniliste andmete võrdlemise teel. "Kuna praegu on neid andmeid vähe, oleks järgmiseks oluliseks sammuks lähenemisviisi laiendamine, et hõlmata ka footonravi ning prootonite ja footonite ning süsinikuioonide ja footonite vastavate riskisuhete määramine," räägib Scholz. Füüsika maailm.