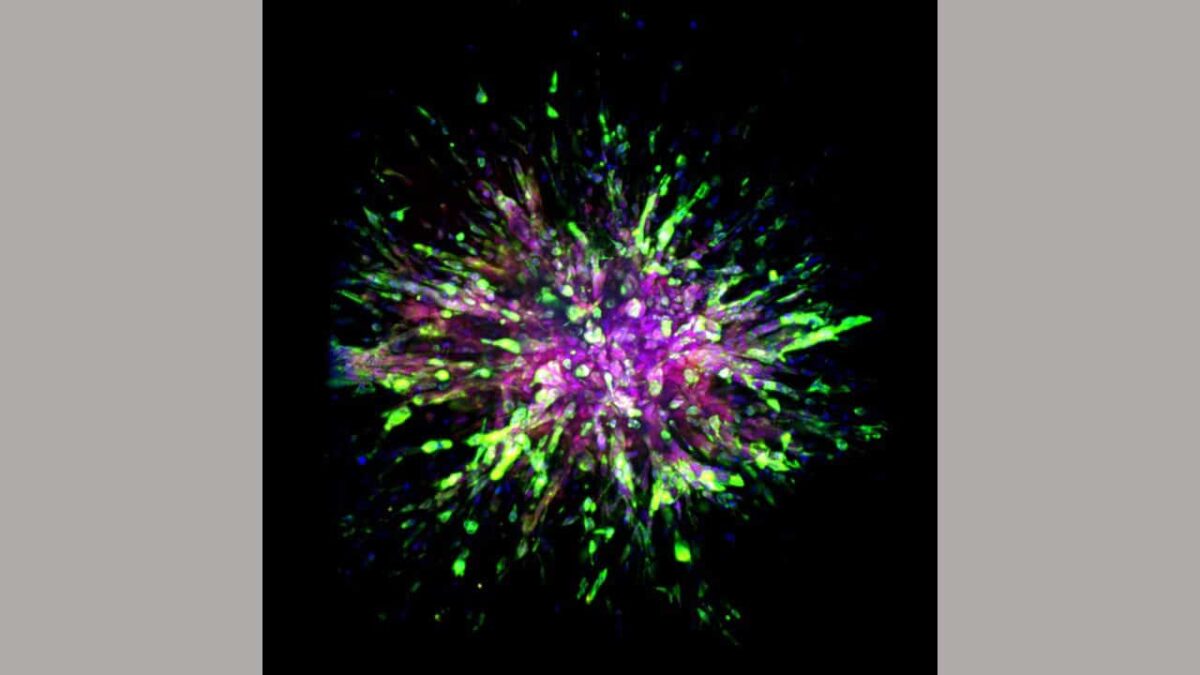
Kolmiknegatiivne rinnavähk (TNBC) on agressiivne alatüüp, mis on seotud varajase metastaatilise kordumise ja halvemate patsientide tulemustega. Kasvaja ekspresseerib epiteeli-mesenhümaalse ülemineku molekulaarseid markereid, kuid selle nõue spontaansete TNBC metastaaside ajal in vivo on endiselt ebatäielikult mõistetav.
Teadlased Johns Hopkins Meditsiin on tuvastanud olulisi molekulaarseid erinevusi vähirakkude vahel, mis klammerduvad esialgse kasvaja külge, ja nende rakkude vahel, mis levivad, moodustades kaugeid kasvajaid.
Andrew Ewald, Ph.D., Virginia DeAcetise põhiteaduste uuringute professor ja Johns Hopkinsi ülikooli meditsiinikooli rakubioloogia osakonna direktor, ütles: "Oleme pikka aega vajanud uusi ravieesmärke ja -võimalusi kolmiknegatiivse rinna jaoks vähk. Need vähid taastuvad sageli kolme aasta jooksul pärast diagnoosimist ja teiste rinnavähkide ravid ei tööta tavaliselt kolmiknegatiivsete puhul.
Teadlased viisid läbi uuringu hiiremudelite ja inimkudedega. See vähivorm on eriti surmav, kuna selle pinnal puuduvad molekulaarsed signaalid, mis seostuvad hormoonide progesterooni ja östrogeen, samuti vähki soodustav valk Her2-neu. Enamik rinnavähk Tänapäeva ravimeetodid on suunatud nendele markeritele, muutes need kolmekordselt negatiivsete kasvajatega patsientide jaoks ebaefektiivseks.
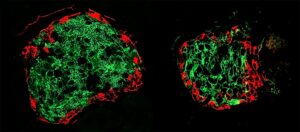
Teadlased jälgisid selles uuringus hoolikalt molekulaarseid erinevusi esialgsete või primaarsete kolmiknegatiivsete rinnavähi piirkondade ja piirkondade vahel, kus see levis, või metastaatiliste kohtade vahel kolme erinevat tüüpi raku vahel: hiiremudelid, hiirtele siirdatud inimese vähid ja proovid. nii primaarsete kui ka metastaatiliste kudede kohta, mis on võetud kaheksalt patsiendilt.
Kasutades selliseid tehnikaid nagu masinõpe, raku pildistamine ja biokeemiline analüüs, tuvastasid teadlased erinevused primaarsete ja metastaatiliste vähivormide genoomse ekspressiooni mustrite vahel.
Ewald ütles, "Meie uuringu halb uudis on see, et metastaatiliste saitide rakud on migratsiooniks ja ravile vastupanuvõimeks ülioptimeeritud. Hea uudis on see, et tuvastasime mitu valku, mida nimetatakse transkriptsioonifaktoriteks, mida need rakud vajavad, et toime tulla metastaatilistes kohtades migreerumise ja õitsenguga. Võib-olla suudame välja töötada uusi ravimeetodeid, mis on suunatud nendele transkriptsioonifaktoritele.
Teadlased märkasid mitmeid iseloomulikke tunnuseid hiirte rakkudes, kellele siirdati inimese kolmiknegatiivse rinnavähi kasvaja või hiirtel, keda on modifitseeritud haiguse hiireversiooni saamiseks. Kõige tähtsam on see, et kolmiknegatiivsete rinnavähirakkude invasioon teise kehaosa teistesse kudedesse saavad rakud kaks rakulist omadust: parem liikumine ja ellujäämine.
Selle saavutamiseks omandavad rinnavähirakud vimentiini rakulise skeleti valgu, mis parandab nn mesenhümaalsete rakkude võimet migreeruda ja uusi rakke genereerida. Mesenhümaalsed rakud on teatud tüüpi rakud, mida tavaliselt leidub luudes ja luuüdi.
Valgu, mida nimetatakse kadheriiniks, tootmine pakub kolmekordselt negatiivsete rinnavähirakkude ellujäämise eeliseid. Valku leidub tavaliselt epiteelirakkudes, mis vooderdavad elundite kanaleid ja katteid ning uuenevad sageli.
Teadlased klassifitseerivad oma raku oleku niinimetatud hübriidsete epiteeli-mesenhümaalsete (EMT) rakkudena, kui kolmiknegatiivsed rinnavähirakud omandavad sellised ellujäämis- ja rändeomadused.
Elana Fertigi, Ph.D., osakonna direktori ja kvantitatiivsete teaduste asedirektori ning Johns Hopkinsi Kimmeli vähikeskuse konvergentsiinstituudi kaasdirektori abiga jälgisid teadlased hoolikalt hübriidsete EMT olekutega seotud molekule. Samuti jälgisid nad üksikute rakkude molekulaarmustreid rakuanalüüsides, mis modelleerivad primaarsest kasvajast väljatungimist ja koloonia moodustumist metastaatilises kohas.
Teadlased kasutasid masinõppe tehnikaid, et tuvastada mustrid iga raku ekspressioonis RNA, valkude sünteesis osaleva DNA sugulane. Teadlased avastasid, et suurem osa metastaatilistest rakkudest muundub hübriidseks EMT olekuks, mis on rändavam ja vastupidavam. Seejärel uurisid teadlased primaarseid kasvajaid ja kudesid samadest patsientide metastaatilistest kohtadest, et kinnitada sarnaseid seisundeid kaheksa kolmekordselt negatiivse pahaloomulise kasvajaga patsiendi proovides.
Molekulaarsel tasandil toodavad enamik metastaatilisi rakke viit valku, mida nimetatakse transkriptsioonifaktoriteks (Grhl2, Foxc2, Zeb1, Zeb2 ja Ovol1), mis soodustavad vähirakkude invasiooni või kolooniate moodustumisega seotud valkude tootmist.
Ewald ütles, "Molekulaarsed erinevused metastaatiliste ja primaarsete kasvajate vahel on tõenäoliselt põhjus, miks metastaatilised kasvajarakud on praeguste ravimeetodite suhtes nii vastupidavad."
Teadlased uurivad praegu viise, kuidas blokeerida transkriptsioonifaktorite geene või nendest tekkivaid valke, et peatada metastaatilise vähi kasvu ja kas samad molekulaarsed ja rakulised muutused toimuvad ka teiste vähivormide puhul, näiteks käärsooles, neerupealistes, maos ja peensooles.
Ajakirja viide:
- Eloise M. Grasset, Matthew Dunworth jt. Kolmiknegatiivne rinnavähi metastaas hõlmab keerulist epiteeli-mesenhümaalse ülemineku dünaamikat ja nõuab vimentiini. Teadus Translatiivsed Meditsiin. DOI: 10.1126/scitranslmed.abn7571