Uus vähiravi on taevas loodud matš.
Ühel pool on CRISPR, geenitöötlustehnoloogia, mis on geenitehnoloogiat tormiliselt haaranud. Teine on teraapia nimega CAR-T, mis muudab normaalsed immuunrakud supersõduriteks, kes jahivad konkreetseid vähktõbe.
Teadlased on pikka aega püüdnud ühendada need kaks suurt edusammu vähktõve "ohutsooniks" - rakuliseks hävitajaks, mis jahib täpseid vähirakke ja võtab nende köha ja hinge. (Top Gun, keegi?)
Idee on suhteliselt lihtne: CAR-T kasutab geenitehnoloogiat, et anda immuunrakkudele täiustatud jälgimisvõime, mis on suunatud teatud tüüpi vähile. CRISPR on tööriist, mis sisestab need jälgimisgeenid immuunrakkudesse.
Kuid praktiliselt on duo kõigi aegade kõige keerulisem teraapia.
Geneetilised muudatused on kohandatud inimese enda vähktõve ründamiseks ja iga tema kasvaja on täis teatud valkude komplekti. Nüüd katsetas Los Angelese California ülikoolis asuv meeskond Nature'i uuringus ravi 16 inimesel, kellel oli mitmesuguseid vähivorme, nagu rinna- või käärsoolevähk. Kohandatud algoritmi abil kujundasid teadlased geneetiliselt muundatud immuunrakkude brigaadi, et sihtida ja hävitada iga inimese teatud tüüpi vähk. Need rakud võivad omada isikupärastatud valgu sihtmärke, säästes samal ajal terveid kudesid.
Mõne nädala jooksul avastas meeskond, et redigeeritud immuunrakud olid vähkkasvajatesse kudedesse nii palju tunginud, et konstrueeritud rakud moodustasid 20 protsenti vähiproovist. See ei ole hõbekuul – see esimene katse on lihtsalt ohutuse hindamiseks. Kuid see näitab, et CRISPR ja CAR-T meeskond on vähihaigetel teostatav. Uuring on esimene samm praeguse vähiravi võimaliku ümberkujundamise suunas, muutes need isiklikumaks ja tõhusamaks ning põhjustades vähem kõrvaltoimeid.
"See on ilmselt kõige keerulisem ravi, mida kliinikus kunagi proovitud on," ütles uuringu autor dr Antoni Ribas California ülikoolist Los Angeleses. "Püüame luua armee patsiendi enda T-rakkudest."
Vähi dilemma
Vähirakud on äärmiselt nutikad.
Nagu kõik rakud, on ka vähirakud väljaspool nende membraani kaetud valkude kattekihiga. Mõned valgud maskeerivad need tervete rakkudena. Teised annavad need ära. Vähirakkude hävitamise põhieesmärk on leida need ainulaadsed vähivalgu "majakad", mida tervetes rakkudes ei leidu. See võimaldab hävitada vähid, jättes normaalsed rakud rahule.
Alates keemiaravist ja lõpetades immunoteraapiaga, oleme kasvajate sihtimisel hästi hakkama saanud. Pole kahtlust, et ravi on päästnud elusid. Kuid ravimeetodid mõjutavad ka keha drastiliselt, peamiselt seetõttu, et nad ei suuda eristada vähki teistest kiiresti kasvavatest rakkudest, näiteks tüvirakkudest.
"Vähktõvega kliinikus patsientide immuunsüsteem kaotas mingil hetkel võitluse ja kasvaja kasvas," ütles uuringu autor dr Stephanie Mandl, Californias Lõuna-San Franciscos asuva PACT Pharma juhtivteadur.
Mida me siis teeme? Sisestage T-lahter.
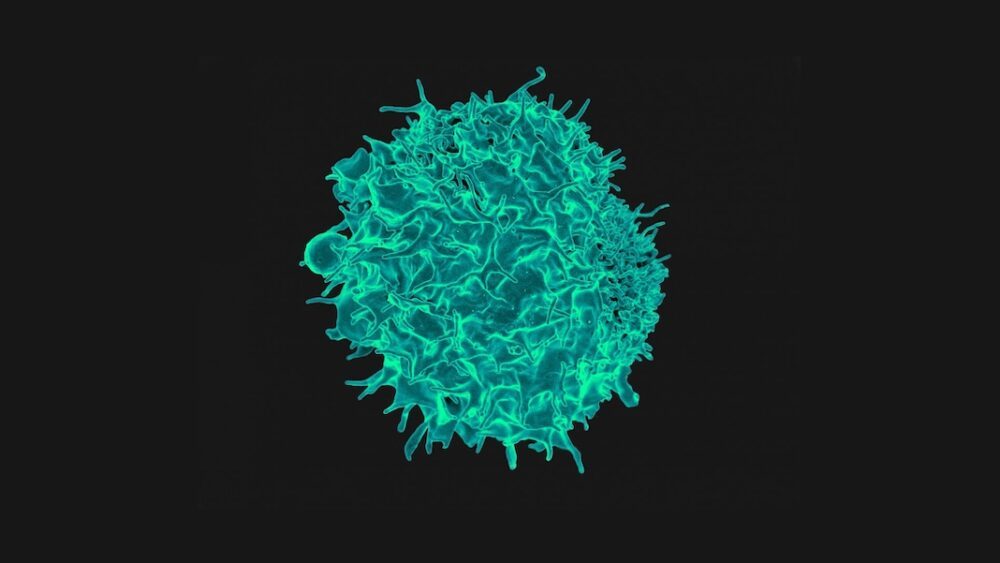
"Inimese immuunsüsteem sobib unikaalselt" vähktõve likvideerimiseks, säästes samal ajal teisi rakke, ütles meeskond. T-rakud, mis on osa immuunsüsteemist, on eriti head tapjad, mis suudavad vähki jahtida, kasutades T-raku retseptoriks ehk TCR-iks kutsutavat "spyglassi" valku. Mõelge TCR-ile kui parimale bioloogilisele seirekaamerale: see suudab tuvastada vaid ühe DNA mutatsiooni, mis tähistab raku vähivormi.
Probleem on selles, et need immuunrakud on kergesti ülekoormatud: üle 24,000 XNUMX erineva vähi mutatsiooniga ei suuda T-rakud nendega kõigiga sammu pidada. CAR-T on viis, kuidas suurendada nende võimet tuvastada spetsiifilisi mutatsioone. Need valgud, mida nimetatakse "neoantigeenideks", märgivad vähirakke, kuna normaalsetes rakke neid ei esine. Tõlge? Neoantigeenid on CAR-T jaoks ideaalsed sihtmärgid.
Jaht algab
Meeskond alustas iga patsiendi kahe prooviga: üks kasvajast ja teine verest. See kõlab kummaliselt, kuid vererakud andsid taustaks normaalsete geneetiliste andmete "tühja tahvli", mille alusel teadlased said vähiproovis muteerunud geene jahtida. Tulemuseks oli üllatav mutatsioonide hulk, mõnel patsiendil kuni 500.
"Mutatsioonid on iga vähi puhul erinevad," ütles Ribas.
Andmete olemasolul kasutas meeskond algoritmi, et kavandada mitu potentsiaalset CAR-T-ravi sihtmärki - neoantigeene või neoTCR-e. Igaüks neist valiti spetsiaalselt T-rakkude rünnaku vallandamiseks, moodustades lõpuks CAR-T-de meeskonna enam kui 175 uue vähiraku valgu sihtmärgiga.
See on siiski riskantne äri. CAR-T ümberkirjutus on keha immuunsüsteem, mis võib põhjustada tõsiseid kõrvaltoimeid. Meeskond on hästi teadlik: nad testisid esmalt neoTCR-i kandidaate tervetes doonori T-rakkudes Petri tassides, et lõpuks otsustada kolme vähi sihtmärgiga patsiendi kohta. Teisisõnu, iga patsiendi T-rakud konstrueeriti nii, et need oleksid suunatud kolmele vähipiirkonnale.
Sisestage CRISPR. Meeskond võttis igalt patsiendilt verd ja eraldas nende T-rakud. Seejärel töödeldi rakke CRISPR-iga, et kustutada kaks immuunsüsteemiga seotud geeni, ja sisestasid need, mis kodeerivad neoTCR-e. See on bioloogiline sööt ja lüliti: äsja sisse lülitatud CAR-T-d on nüüd teoreetiliselt pühendunud vähikütid, kes ei kahjusta normaalseid rakke.
Üldiselt oli see üsna kiire protsess: meeskond suurendas konstrueeritud supersõdurirakkude arvu vaid 11 päevaga. Pärast seda, kui patsiendid võtsid ravimeid, et piirata nende normaalset immuunrakkude arvu, infundeeris meeskond konstrueeritud vähivastaseid rakke oma kehasse. Võttes mitu verevõttu, leidis töörühm suures koguses muudetud rakke, mis ringlevad nende veres ja paiknesid nende üksikute kasvajate ümber.
Kindel rada
Katse eesmärk oli peamiselt hinnata ohutust. Kuid näis, et patsientidel oli sellest kasu. Üks kuu pärast infusiooni oli viie inimese vähk stabiliseerunud – see tähendab, et nende kasvajad ei olnud kasvanud – ja ainult kahel inimesel tekkis ravi immuunsüsteemi kõrvalmõjusid.
"See uuring… on oluline, kuna esimene inimkatse tahkete vähivormide kohta näitab patsiendile spetsiifiliste, CRISPR-tehnoloogiaga loodud T-rakkude kasutamist, mis on võimelised tuvastama spetsiifilisi antigeene või "lippe" patsiendi kasvajarakkudel, ajendades neid tapma. neid,” ütles doktor Astero Klampatsa Londoni Vähiuuringute Instituudist, kes ei osalenud uuringus.
Kuigi CAR-T-l on olnud verekasvajate ravimisel tohutu edu, on tehnoloogial olnud raskusi tahkete kasvajate osas enamiku vähivormide puhul, nagu rinna-, kopsu- või maovähi puhul.
Uuring ei paku lõplikku ravi. Ühel patsiendil tekkis immuunreaktsioon palaviku ja valgete vereliblede kadumisega. Teisel tekkis ajutine põletik ajus, mis põhjustas kõndimise ja kirjutamise probleeme, kuid nad paranesid pärast ravi kiiresti. Ja kuigi konstrueeritud T-rakkude kõrge tase korreleerus mõne, kuid mitte kõigi vähenenud suurusega vähktõvega, ei ole veel teada, kuidas ravi võib aidata pikaajalist taastumist.
Siiski on meeskond praegu lootusrikas.
Vaadates ette järgmise põlvkonna CRISPRed CAR-T-sid, näeb meeskond ette rakke, mis metaboolselt ellu ärkavad, kui läheduses kasvab kasvaja, hoiatades keha võimaliku vähi eest. Teine idee on kaitsta geneetiliselt täiustatud rakke vähisõja eest. Kasvajarakud võivad saata välja signaale, mis pärsivad immuunrakke – geneetiline barjäär võib anda meile ülekaalu, võimaldades konstrueeritud rakkudel kauem vastu pidada, kui nad patrullivad kehas vähi tunnuste suhtes.
Need on ideed, mille kallal meeskond töötab. Kuid praegu "oleks huvitav näha, kas seda ravi rakendatakse suuremas katses, kus saab täiendavalt testida efektiivsust, aga ka katseprotokolle," ütles Klampatsa.
Image Credit: T-raku värviline skaneeriv elektronmikroskoopia. NIAD