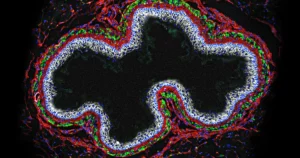
دانشمندان علوم اعصاب که علاقه مند به نحوه عملکرد مغز هستند، به طور طبیعی بر نورون ها تمرکز می کنند، سلول هایی که می توانند عناصر حس و فکر را از طریق تکانه های الکتریکی به یکدیگر منتقل کنند. اما ماده ای که بین آنها قرار دارد به همان اندازه ارزش مطالعه دارد - یک پوشش چسبناک در خارج از این نورون ها. تقریباً معادل غضروف در بینی و مفاصل ما، این مواد مانند تور ماهیگیری به برخی از نورونهای ما میچسبند و نام شبکههای عصبی (PNN) را الهامبخش میکنند. آنها از زنجیره های بلندی از مولکول های قند تشکیل شده اند که به داربست پروتئینی متصل هستند و نورون ها را در جای خود نگه می دارند و از جوانه زدن و ایجاد اتصالات جدید جلوگیری می کنند.
با توجه به این توانایی، این پوشش عصبی کمتر شناخته شده پاسخ هایی به برخی از گیج کننده ترین سوالات در مورد مغز ارائه می دهد: چرا مغزهای جوان اطلاعات جدید را به راحتی جذب می کنند؟ چرا فراموش کردن خاطرات ترسناکی که با اختلال استرس پس از سانحه (PTSD) همراه است بسیار دشوار است؟ چرا بعد از وابستگی به الکل ترک نوشیدن آنقدر سخت است؟ و با توجه به تحقیق جدید از متخصص مغز و اعصاب Arkady Khoutorsky و همکارانش در دانشگاه مک گیل، ما اکنون می دانیم که PNN ها همچنین توضیح می دهند که چرا درد می تواند تا مدت ها پس از آسیب عصبی ایجاد شود و ادامه یابد.
انعطاف پذیری عصبی توانایی شبکه های عصبی برای تغییر در پاسخ به تجربیات زندگی یا ترمیم خود پس از آسیب مغزی است. چنین فرصت هایی برای تغییر بدون زحمت به عنوان دوره های بحرانی شناخته می شوند که در اوایل زندگی رخ می دهند. در نظر بگیرید که نوزادان چقدر راحت زبان را یاد می گیرند، اما یادگیری یک زبان خارجی در بزرگسالی چقدر دشوار است. به نوعی، این چیزی است که ما میخواهیم: پس از تشکیل شبکههای عصبی پیچیده که به ما امکان میدهد زبان مادری خود را بفهمیم، مهم است که آنها قفل شوند، بنابراین شبکهها تا پایان عمر نسبتاً بدون مزاحمت باقی میمانند.
این بدان معناست که پس از یک دوره بحرانی، شبکه های عصبی در برابر تغییرات مقاوم می شوند و PNN ها دلیل اصلی آن هستند. آنها روی نورون ها شکل می گیرند و در پایان دوره بحرانی سیم کشی شبکه عصبی را در جای خود قفل می کنند. این اغلب در سنین 2 تا 8 سالگی اتفاق میافتد، اما PNN در بزرگسالی در ارتباط با رفتارهایی که به سختی شکسته میشوند یا در شکلگیری خاطرات بلندمدت روی نورونها شکل میگیرند. اگر بتوانیم بسته شدن دورههای بحرانی را به تأخیر بیندازیم، یا به نحوی دوباره آنها را بعداً در زندگی باز کنیم، این کار انعطافپذیری عصبی جوانی را بازیابی میکند، بهبودی از آسیب را بهبود میبخشد و اختلالات عصبی دشواری را که در برابر تغییر مقاوم هستند خنثی میکند.
تحقیقات اخیر نشان می دهد که این کار را می توان به سادگی با دستکاری PNN ها انجام داد. به عنوان مثال، نگه داشتن یک حیوان در تاریکی کامل، رشد PNN ها را بر روی نورون های بینایی کند می کند، و باز نگه داشتن دوره بحرانی برای انعطاف پذیری عصبی برای اصلاح مشکلات بینایی بسیار طولانی تر است. عوامل شیمیایی و دستکاری ژنتیکی همچنین می توانند PNN ها را تخریب کرده و دوره های بحرانی را دوباره باز کنند، و محققان این کار را انجام داده اند تا موش ها خاطراتی را که باعث PTSD آنها شده است فراموش کنند (در مورد آنها، خاطرات شوک الکتریکی بلافاصله پس از شنیدن صدای صدا).
همچنین امکان تحریک رشد PNN وجود دارد. این زمانی اتفاق میافتد که فردی بیش از حد الکل بنوشد، که منجر به تشکیل این شبکهها بر روی نورونهای درگیر در اعتیاد میشود. اعتقاد بر این است که این پوشش از نورونها در برابر سمیت شیمیایی الکل محافظت میکند، اما فرآیند فکری را که باعث ایجاد میل شدید به نوشیدن میشود، قفل میکند.
در حالی که دانشمندان علوم اعصاب در چند دهه گذشته در مورد این جنبه های PNN ها یاد گرفته اند، تأثیر PNN ها بر درد مزمن یک کشف غیرمنتظره اخیر بود. این کار، که نفوذ شبکهها را فراتر از دورههای بحرانی گسترش میدهد، نه تنها درک ما را از علم پایه درد بهبود میبخشد، بلکه تصویر بهتری از خود PNN به ما میدهد.
درد مزمن، که مدتها پس از آسیب ادامه مییابد، نشاندهنده تغییر در مدار عصبی است که غلبه بر آن دشوار است. وقتی چیزی درد می کند، تمام بدن ما درگیر می شود. نورون های تخصصی درد در سراسر بدن، تکانه های عصبی را به نخاع منتقل می کنند، جایی که به مغز منتقل می شوند. این بدان معناست که نخاع نقش مهمی در احساس درد ما دارد. در واقع، پزشکان اغلب درد زایمان را با تجویز اپیدورال، که شامل تزریق مواد بیحس کننده به فضای اطراف نخاع کمری است، کنترل میکنند و مانع رسیدن تکانههای عصبی به مغز میشوند.
حال تصور کنید به جای سرکوب انتقال عصبی در این مرحله، آسیب عصبی آن نورون ها را بیش از حد حساس کند. حتی یک لمس ملایم در ناحیه آسیب دیده باعث می شود رگباری از تکانه های عصبی به سمت نخاع حرکت کند و به عنوان درد شدید ثبت شود. تحقیقات قبلی مکانیسمهای مختلفی را شناسایی کردند که میتوانند چنین حساسیتزایی را ایجاد کنند، اما هیچکس انتظار نداشت که PNNها دخیل باشند.
با این حال، چند سال پیش، Khoutorsky مقالهای را دید که گزارش میداد PNNها نورونهای کوچک خاصی را در ناحیهای از مغز که در آن اطلاعات درد منتقل میشود، پوشش میدهند. این "بین نورون های بازدارنده" سیناپس هایی را روی نورون های درد تشکیل می دهند و توانایی آنها را برای انتقال سیگنال های درد سرکوب می کنند. Khoutorsky تعجب کرد که آیا PNN ها ممکن است کاری مشابه در نقطه رله درد بحرانی در داخل نخاع انجام دهند، و از دانشجوی فارغ التحصیل خود شانون تانسلی خواست تا آن را بررسی کند. خوتورسکی گفت: «در آن زمان هیچ چیز مشخص نبود.
تانسلی در واقع متوجه شد که PNN ها نورون های خاصی را در نخاع محصور می کنند، جایی که سیگنال های درد را به مغز منتقل می کند. نورونها آکسونهای بلندی دارند ("دم" که سیگنالها را به سلول بعدی در صف ارسال میکند) که نخاع را به سمت مغز هدایت میکند. آنها همچنین دارای مجموعهای از نورونهای بازدارنده هستند که از طریق سوراخهای کوچکی در PNN به آنها متصل شدهاند، و نورونهای بازدارنده میتوانند شلیک نورونهای بلند بیرون زده را مهار کنند، سیگنال رسیدن به مغز را کوچک کرده و احساس درد را کمرنگ میکنند. تانسلی در کمال تعجب متوجه شد که فقط این نورون های بازدارنده در نقطه رله نخاع با PNN پوشیده شده اند.
این یافته الهام بخش تیم Khoutorsky شد تا آزمایشاتی را بر روی موش های آزمایشگاهی انجام دهند تا تعیین کنند که آیا این شبکه ها به نوعی در درد مزمن پس از آسیب عصب محیطی دخالت دارند یا خیر. آنها شاخه های عصب پای عقب موش را که به سیاتیک معروف است، در حالی که تحت بیهوشی عمومی بود، بریدند. این آسیبهای سیاتیک را در افراد تقلید میکند، که به علت درد مداوم شناخته شده است. چند روز بعد، تیم Khoutorsky آستانه درد موش را با آزمایشهای غیر مضر اندازهگیری کردند، مانند زمانبندی سرعت عقبنشینی موش از سطح گرم شده. همانطور که انتظار می رفت، تیم مشاهده کردند که نمایشگر ماوس به شدت حساسیت درد را افزایش می دهد - اما آنها همچنین متوجه شدند که PNN در اطراف نورون های بیرون زده حل شده است. همانطور که تغییرات مغز در دوره های بحرانی بر PNN تاثیر می گذارد، تغییرات ناگهانی پس از آسیب عصبی در موش باعث تغییر PNN در مدار درد نخاع شده است.
سپس تیم متوجه شد که چه چیزی باعث تخریب تورها شده است: میکروگلیا، سلولهای مغز و نخاع که شروع به ترمیم پس از بیماری و آسیب میکنند. برای آزمایش ارتباط بین میکروگلیا و درد، این تیم به موشهایی روی آوردند که عملاً میکروگلیا نداشتند (که با مهندسی ژنتیک ممکن شد) و همین عمل را انجام دادند. در این موش ها، PNN ها پس از جراحی عصب سیاتیک دست نخورده باقی ماندند و قابل توجه است که موش ها نسبت به محرک های دردناک حساس نشدند. برای تایید این ارتباط، تیم از ابزارهای مختلفی برای حل کردن تورها استفاده کرد که حساسیت موش ها به درد را افزایش داد.
این ثابت کرد که PNN ها مستقیماً حساسیت درد را سرکوب می کنند. با اندازه گیری انتقال سیناپسی با الکترود، تیم Khoutorsky حتی نحوه کارکرد آن را نیز دریافتند. تخریب PNN ها باعث واکنش زنجیره ای می شود که منجر به افزایش سیگنال از نورون های بیرون زده که سیگنال های درد را به مغز می فرستند: وقتی میکروگلیا که به آسیب عصبی پاسخ می دهد PNN ها را حل می کند، این امر تأثیر نورون های بازدارنده را تضعیف می کند که معمولاً شلیک را کاهش می دهند. نورون های فرافکنی مغز از دست دادن ترمزهای بازدارنده آنها به معنای شلیک عصبی و درد شدید بود.
میکروگلیا مواد بسیاری را آزاد می کند که باعث می شود نورون های درد پس از آسیب عصبی بیش از حد حساس شوند، اما عملکرد غیرمنتظره آنها روی PNN ها یک مزیت عمده دارد: ویژگی. خوتورسکی گفت: «معمولاً کاری که شبکههای اطراف عصبی انجام میدهند این است که انعطافپذیری را قفل میکنند و همچنین از سلولها محافظت میکنند. پس چرا این شبکهها فقط در اطراف این نورونهای رله درد هستند و نه در اطراف انواع سلولهای دیگر [در نزدیکی]؟ او مشکوک است که به این دلیل است که این نقطه رله درد در نخاع بسیار مهم است که این نورون ها و اتصالات آنها به محافظت بیشتری نیاز دارند تا کنترل انتقال درد قوی و قابل اعتماد باشد. فقط چیزی به اندازه یک آسیب عصبی می تواند این ثبات را مختل کند.
خوتورسکی گفت: "زیبایی این مکانیسم این است که برای انواع سلول های خاص انتخابی است." مواد میکروگلیا برای افزایش شلیک عصبی و ایجاد درد پس از آسیب عصبی بر همه انواع سلول های مجاور تأثیر می گذارد، اما PNN ها فقط این نورون ها را دقیقاً در نقطه رله بحرانی در نخاع می پوشانند.
تحقیقات برای درک بهتر این مکانیسم جدید درد مزمن در حال انجام است. اگر محققان بتوانند روشهایی را برای بازسازی PNN روی این نورونها پس از آسیب ایجاد کنند، میتواند درمان جدیدی برای درد مزمن ارائه دهد - یک نیاز فوری، با توجه به اینکه مواد افیونی، راه حل فعلی، قدرت خود را در طول زمان از دست میدهند و میتوانند اعتیادآور شوند یا منجر به مرگ شوند. مصرف بیش از حد
آنچه در داخل نورون ها می گذرد بسیار جذاب و مهم است که درک کنیم، اما شبکه های عصبی توسط نورون های فردی که به هم مرتبط هستند تشکیل می شوند و در اینجا این سیمان غضروفی نادیده گرفته شده در فضای بین آنها است که حیاتی است.