ذرات درمانی - درمان سرطان با استفاده از پرتوهای پروتون یا یونهای سنگینتر - نسبت به رادیوتراپی مبتنی بر فوتون معمولی، دوز بسیار منطبق و صرفهجویی بیشتری را در بافتهای طبیعی فراهم میکند. اما برای بازماندگان طولانی مدت سرطان، خطر ابتلا به سرطان ثانویه ناشی از تشعشع (SC) مهم است و باید هنگام انتخاب روش درمانی آنها در نظر گرفته شود.
در حالی که داده های اپیدمیولوژیک برای درمان های جدیدتر مانند درمان با پروتون و یون کربن کمیاب است، تیمی در مرکز تحقیقات یون های سنگین GSI هلمهولتز در حال توسعه مدلی برای مقایسه خطرات SC بین روش های ذره درمانی است. مدل، توصیف شده توسط آنتونیا هوفناگل و همکاران در فیزیک پزشکی، در نهایت می تواند در سیستم های برنامه ریزی درمان گنجانده شود تا ریسک SC را به عنوان یک معیار بهینه سازی اضافی لحاظ کند.
حوادث مرگبار در مقابل سرطان زا
مدلهای خطر SC معمولاً با در نظر گرفتن تعادل بین کشتن سلولی (که منجر به سرکوب سرطان میشود) و تبدیل سلولی (القای جهشهایی که در نهایت منجر به سرطان میشود) کار میکنند. احتمال ایجاد سرطان در یک حجم تابش شده با استفاده از مدل خطی-مربع (LQ) تعریف میشود که یک رابطه ساده بین بقای سلول و دوز فوتون تحویلی را فراهم میکند.
در این مطالعه، محققان از مدل اثر موضعی (LEM) برای پیشبینی اثربخشی بیولوژیکی نسبی (RBE) القای SC پس از درمان با ذرات استفاده کردند. برای توضیح افزایش RBE تابش ذرات، آنها پارامترهای LQ فوتون را در مدل ریسک با پارامترهای LQ پرتو یونی پیشبینی شده توسط LEM جایگزین کردند. یکی از ویژگی های کلیدی رویکرد آنها استفاده از LEM در هر دو اصطلاح کشتن سلول و القای سرطان است.

نویسنده ارشد توضیح می دهد: "استفاده مضاعف از LEM نشان دهنده رقابت بین دو فرآیند اصلی تعیین کننده توسعه SC، یعنی تبدیل سلولی و کشتن سلولی است." مایکل شولز. با افزایش دوز و/یا اثربخشی، کشتن سلولی میتواند حیات سلولهای تبدیلشده را سرکوب کند. این منجر به یک فعل و انفعال پیچیده می شود که نمی توان آن را به سادگی در یک روش یک مرحله ای منعکس کرد.
برای بررسی اینکه چه عواملی بر ریسک SC تأثیر میگذارند، محققان از سیستم برنامهریزی TPS TRiP98 برای تولید طرحهای تصفیه بیولوژیکی یون کربن و پروتون بر اساس یک هندسه ایدهآل استفاده کردند. نقشه ها به یک هدف 4x4x4 سانتی متری با یک پرتو ذره یا دو پرتو متضاد با یک ارگان در معرض خطر (OAR) 4x4x1 سانتی متر در جلوی هدف تابش کردند. به دلیل عدم قطعیت در پارامترهای LQ فوتون مورد استفاده به عنوان ورودی برای LEM، آنها نسبت خطر پروتون به یون کربن را به جای مقادیر ریسک فردی تخمین زدند.
برای این مجموعههای ایدهآل، مدل ترجیح واضحی برای پروتون یا یونهای کربن نشان نداد، اما وابستگی پیچیدهای به پارامترهای مختلف نشان داد. کاهش پراکندگی جانبی یون های کربن منجر به خطر SC کمتری نسبت به پروتون ها در کانال ورودی می شود. با این حال، یونهای کربن به دلیل دم تکه تکه شدن، دوز بالاتری را در پشت هدف قرار میدهند و خطر SC را برای OARهای پشت تومور پس از تابش یون کربن افزایش میدهد.
برای طرح های تک پرتو، کل خطر SC تقریباً 1.5 برابر بیشتر از یون های کربن نسبت به پروتون ها بود. با دو پرتو مخالف، کل خطر SC برای پروتون ها 1.16 برابر بیشتر بود، اگرچه این به شدت بسته به مکان فضایی حجم حساس فرضی با توجه به حجم هدف متفاوت بود.
حساسیت پرتویی بافت (به فوتون ها) تأثیر عمده ای بر نسبت خطر SC داشت، با OAR های مقاوم در برابر پرتو از درمان یون کربن و OAR های حساس از پرتوهای پروتون بهره مند شدند. در مقابل، طرح تفکیک تاثیر کمی بر مقادیر ریسک مورد انتظار داشت.
هندسه بیمار
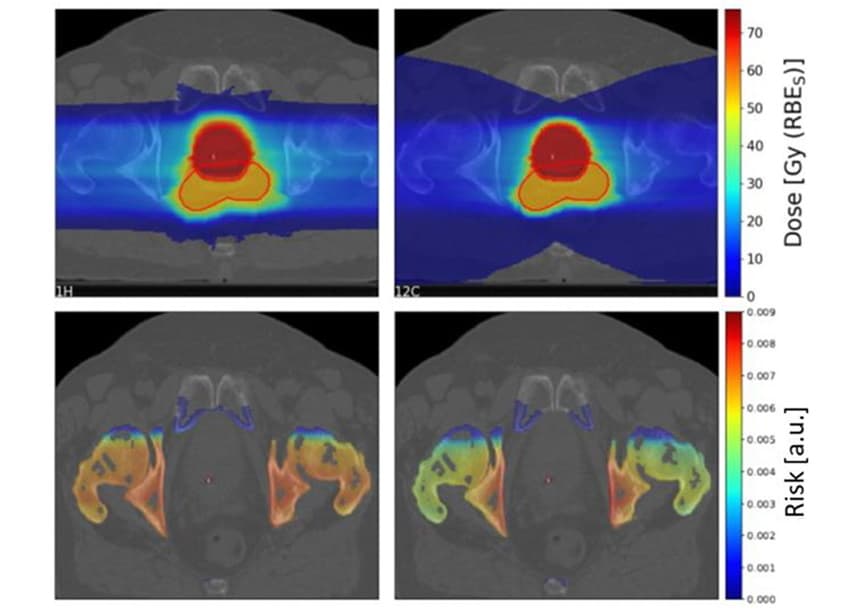
برای بررسی سناریوهای بالینی، شولز و همکارانش خطرات SC را برای 10 بیمار سرطان پروستات که قبلاً با رادیوتراپی فوتون در بیمارستان دانشگاه کارولینسکا درمان شده بودند، تخمین زدند. آنها با استفاده از دو میدان پروتون و کربن یون اسکن شده در جهت مخالف، طرح های درمانی برای بیماران ایجاد کردند.
همانطور که قبلا دیده شد، دم تکه تکه شدن یون های کربن منجر به ایجاد یک منطقه بزرگ با دوز پایین در پشت هدف شد. با این حال، منطقه هدف با دوز بالا برای یون کربن سازگارتر از طرح های پروتون بود.
این تیم، نسبت خطر پروتون به کربن یون SC را برای چهار OAR (مثانه، رکتوم، استخوان ها و پوست) برای 10 بیمار محاسبه کرد. برای استخوان و پوست، طرحهای پروتون خطر SC کمی بالاتر از طرحهای یون کربن به همراه داشت، با نسبتهای خطر متوسط 1.19 و 1.06 برای استخوان و پوست، به ترتیب. با این حال، برای مثانه و رکتوم، طرح های پروتون منجر به خطرات SC به طور قابل توجهی کمتری شد، با نسبت های خطر 0.68 و 0.49 برای مثانه و راست روده، به ترتیب.
محققان نتیجه می گیرند که بینش های به دست آمده توسط این مدل می تواند به بهینه سازی درمان های آینده کمک کند. در حال حاضر، مدلسازی ریسک نسبی عمدتاً به عنوان ابزاری برای مقایسه سناریوهای درمانی مختلف برای گروههای مختلف بیماران مناسب است. اما شولز خاطرنشان می کند که گنجاندن چنین مدل هایی در برنامه ریزی درمانی برای بیماران فردی ساده است.

درمان شبکه یون کربن بافت سالم را حفظ می کند
او توضیح میدهد: «این فقط نیازمند اجرای برنامهریزی برای توزیع دوز معین با دو مجموعه پارامترهای بیولوژیکی مختلف است که به ترتیب نشاندهنده کشتن سلولی و فرآیند تبدیل سلولی است». پس از آن، برای استخراج توزیعهای نسبت ریسک مربوطه، تنها مقداری پس پردازش توزیعهای اثر سهبعدی حاصل با ابزارهای ریاضی استاندارد مورد نیاز است.
او میگوید گام بعدی اعتبارسنجی مدل از طریق مقایسه با دادههای بالینی است. شولز میگوید: «از آنجایی که در حال حاضر این دادهها کمیاب هستند، گسترش رویکرد شامل درمانهای فوتون و تعیین نسبتهای خطر مربوط به پروتونها در مقابل فوتونها و یونهای کربن در مقابل فوتونها، گام بعدی مهم خواهد بود». دنیای فیزیک.