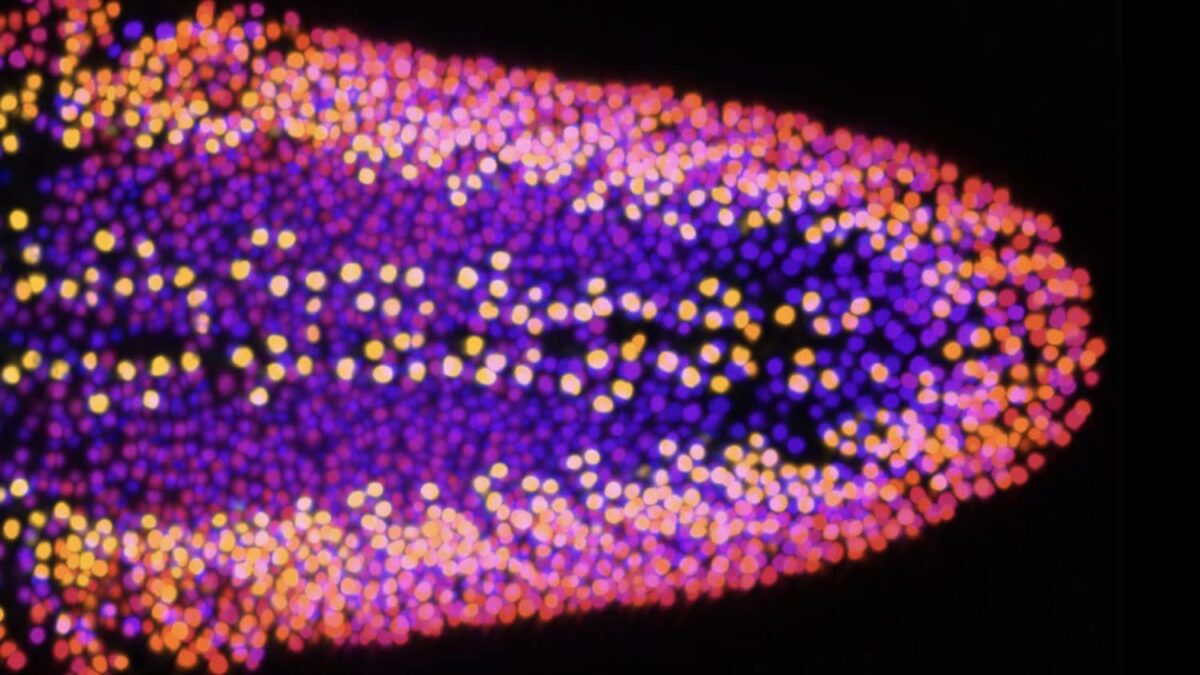
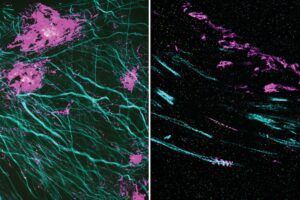
Les protéines atypiques qui créent des enchevêtrements dans le cerveau et détruisent les neurones entraînent des troubles neurodégénératifs.
Neurobiologistes à EPFL ont maintenant identifié certains mécanismes clés sous-jacents à la formation de ces enchevêtrements. Ils ont également observé la vulnérabilité des cellules au début de la neurodégénérescence.
Selon les scientifiques, arrêter ou ralentir la première déconnexion des neurones pourrait ralentir les étapes suivantes à mesure que les neurones commencent à dégénérer.
Dans cette étude, les scientifiques ont conçu des modèles d'apparition à l'âge adulte pour la toxicité humaine de Tau (hTau) chez la drosophile (mouche des fruits). Cela a permis une mesure quantitative en fonction de l'âge de la perte de synapse du système nerveux central et de la dégénérescence axonale, ainsi que des effets sur la durée de vie, pour faciliter l'évaluation des facteurs contribuant à la neurodégénérescence dépendante de Tau. Tau est une protéine impliquée dans La maladie d'Alzheimer et d'autres troubles qui entraînent démence.
Les scientifiques ont découvert que les mouches, qui exprimaient le Tau humain, avaient une durée de vie plus courte que les témoins. Plus tard, ils ont accédé à l'effet du Tau humain sur le cerveau en utilisant une série de technologies génétiques, microscopiques et informatiques qui ont permis une imagerie précise de l'individu neurones.
C'est la première fois que des scientifiques peuvent étudier la neurodégénérescence au niveau d'un seul neurone dans le contexte d'un cerveau adulte.
Par rapport aux témoins, les mouches exprimant Tau humain ont montré une perte substantielle de synapses ou de connexions entre les neurones. Chez ces animaux, les neurones axones aussi rétréci et rétracté.
L'auteur principal de l'étude, Brian McCabe, directeur du Laboratoire de génétique neurale et des maladies et professeur à la Faculté des sciences de la vie de l'EPFL, a déclaré : « Au moment où l'axone s'est rétracté, les neurones ne faisaient plus partie d'un circuit fonctionnel. Nous devons intervenir à ces stades très précoces car lorsque les neurones meurent, la bataille est déjà perdue.
Des recherches supplémentaires ont révélé que la neurodégénérescence est accélérée par la perte du rétromère, un complexe protéique qui peut être muté chez les personnes atteintes Maladie de Parkinson. Le rétromère fonctionne comme système de recyclage, empêchant les protéines d'être décomposées et les ramenant à la surface de la cellule. Le blocage de l'activité du complexe rétromère entraîne une augmentation des niveaux d'une forme raccourcie de Tau qui exacerbe la neurotoxicité.
Les scientifiques ont noté, «Lorsque l'activité des rétromères est réduite, les protéines Tau persistent plus longtemps à l'intérieur de la cellule, où elles sont «coupées» par des enzymes spécialisées appelées caspases. En effet, inhiber la production de la forme raccourcie de Tau pourrait bloquer la perte de synapses et d'axones.
McCabe a affirmé Valérie Plante., "Les résultats suggèrent que l'atténuation de l'activité des rétromères ralentit le trafic de Tau. Cet «embouteillage» permet aux caspases de couper Tau en une forme plus courte qui peut endommager les neurones. L'identification des médicaments qui améliorent le trafic de Tau pourrait aider à réduire la neurotoxicité.
"Si la forme raccourcie de Tau est un marqueur diagnostique pour les cerveaux affectés par la maladie d'Alzheimer et de Parkinson, les niveaux de cette protéine atypique pourraient être utilisés dans le dépistage des médicaments comme indicateur de l'efficacité des médicaments."
Les scientifiques continuent de comprendre les premières étapes de la neurodégénérescence.
Journal de référence:
- Asadzadeh, J., Ruchti, E., Jiao, W. et al. Le déficit en rétromère dans les modèles de tauopathie améliore la troncature et la toxicité de Tau. Nat Commun 13, 5049 (2022). EST CE QUE JE: 10.1038/s41467-022-32683-5