Introduction
Fermez les yeux et imaginez des bactéries. Peut-être que vous imaginez notre intestin Escherichia coli, ou les boules dorées brillantes du staphylocoque, ou les boucles en tire-bouchon des spirochètes de la maladie de Lyme. Indépendamment de l'espèce et de sa forme, il y a de fortes chances que votre esprit ait évoqué une seule cellule, ou peut-être plusieurs cellules libres.
Le problème avec cette image, dit le microbiologiste Julia Schwartzmann, c'est qu'il ne reflète pas la façon dont la plupart des bactéries sont susceptibles de vivre. Souvent, les bactéries utilisent des molécules collantes pour s'ancrer à une surface, se développant dans grands collectifs stables appelés biofilms. La plaque sur vos dents est un biofilm ; il en va de même pour les infections sur les cathéters, le vert visqueux de l'écume des étangs et la crasse qui obstrue le drain de votre baignoire.
Mais les travaux récents de Schwartzman, qu'elle a menés en tant que boursière postdoctorale dans le laboratoire de Otto Cordero au Massachusetts Institute of Technology, montre que même les bactéries flottant en haute mer, qui n'ont pas de point d'ancrage pour former de grands conglomérats, existent sous des formes multicellulaires.
"Nous avons vu ces structures qui étaient tout simplement incroyables", a-t-elle déclaré.
Comme Schwartzman, Cordero et leurs collègues l'ont montré dans leur article récent en Current Biology, ces formes multicellulaires sont apparues parce que les bactéries ont développé un cycle de vie beaucoup plus complexe que celui habituellement observé chez les organismes unicellulaires.
Compagnie pour le dîner
Schwartzman est venu à ces découvertes sur la multicellularité des bactéries marines tout en essayant d'apprendre quelque chose de plus fondamental : comment elles se nourrissent.
En pleine mer, souvent la seule source d'énergie pour les microbes marins est un glucide gélatineux appelé alginate. Contrairement au glucose, au fructose et à d'autres sucres simples qui peuvent facilement traverser une membrane cellulaire, l'alginate est composé de longs brins enroulés qui sont souvent plus gros que les bactéries qui s'y nourrissent. Schwartzman voulait en savoir plus sur la façon dont les bactéries se nourrissent efficacement, car les enzymes digestives qu'elles sécrètent pour décomposer l'alginate pourraient facilement être diluées et emportées dans les eaux océaniques ouvertes.
C'est pourquoi elle et Ali Ebrahimi, un autre postdoctorant du laboratoire de Cordero, ont commencé à mesurer la croissance de la bactérie marine luminescente Vibrio splendide dans des flacons de bouillon tiède chargé d'alginate. Dans de nombreuses expériences de microbiologie, les scientifiques fournissent aux microbes un assortiment de nutriments pour encourager les cellules à se diviser le plus rapidement possible, mais les flacons de Schwartzman et Ebrahimi ont forcé le Vibrio les bactéries subsistent sur des quantités relativement faibles de polymères d'alginate surdimensionnés, tout comme elles le font dans la mer.
Pourtant, lorsque Schwartzman a commencé à collecter des données, elle a pensé qu'elle avait fait une erreur de débutant. Au fur et à mesure que les bactéries se multiplient, elles transforment le bouillon de culture clair de couleur ambrée en un ragoût trouble. En mesurant l'opacité, Schwartzman a pu extrapoler le nombre de microbes dans le flacon et construire une courbe de croissance pour estimer la vitesse de division des cellules. Les bactériologistes ont estimé les taux de croissance de cette façon pendant des décennies. En tant que postdoctorante, Schwartzman avait perdu le compte du nombre de fois qu'elle avait fait cela au fil des ans.
La courbe de croissance pour elle Vibrio cultures, cependant, ne montraient pas la ligne montante régulière habituelle, mais plutôt un gribouillis cahoteux comme la piste d'une montagne russe. Peu importe combien de fois elle a répété le processus, les bactéries n'ont pas produit le trouble attendu dans le bouillon.
Une boule à neige microscopique
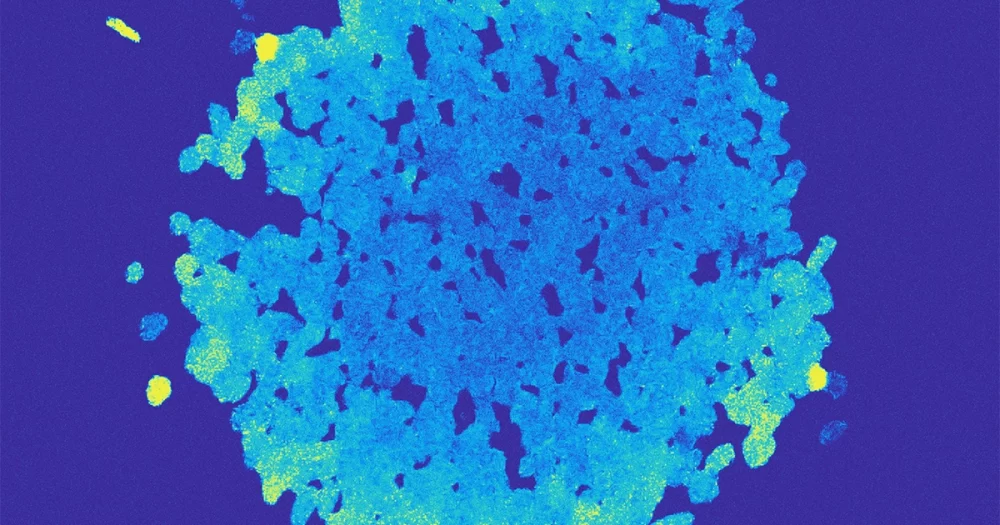
Pour vérifier ce qui se passait, Schwartzman a déposé une goutte de la solution de culture sur une lame de microscope en verre et a regardé à travers la lentille à un grossissement de 40 fois. Ce qu'elle et Ebrahimi ont vu n'étaient pas des essaims d'individus Vibrio mais plutôt de belles orbes en couches composées de centaines ou de milliers de bactéries vivant ensemble.
"Ce n'était pas seulement une masse de bactéries", a déclaré Schwartzman. "C'est une chose sphérique, et vous pouvez voir les cellules se mélanger au milieu."
D'autres travaux ont montré que les sphères creuses étaient Vibrioest la solution au défi compliqué de manger en mer. Une bactérie individuelle ne peut produire qu'une quantité limitée d'enzymes ; la décomposition de l'alginate va beaucoup plus rapidement lorsque Vibrio peuvent se regrouper. C'est une stratégie gagnante, dit Schwartzman - jusqu'à un certain point. S'il y a trop Vibrio, le nombre de bactéries dépasse l'alginate disponible.
Les bactéries ont résolu l'énigme en développant un cycle de vie plus complexe. Les bactéries vivent en trois phases distinctes. Au début, une cellule individuelle se divise à plusieurs reprises et les cellules filles se regroupent en amas croissants. Dans la deuxième phase, les cellules agglutinées se réorganisent en une sphère creuse. Les cellules les plus externes se collent ensemble, formant quelque chose comme une boule à neige microscopique. Les cellules à l'intérieur deviennent plus mobiles, nageant au fur et à mesure qu'elles consomment l'alginate piégé. Dans la troisième phase, la couche externe fragile se rompt, libérant les cellules internes bien nourries pour recommencer le cycle.
En effet, Vibrio devenir un mélange hétérogène de cellules, les bactéries utilisant différents gènes pour contrôler leur comportement à chaque phase. Au fur et à mesure que les cellules interagissent avec leurs voisines dans la structure, ce qui émerge est "une quantité surprenante de complexité", a déclaré Schwartzman, qui lance son propre laboratoire à l'Université de Californie du Sud en janvier. "Les bactéries absorbent constamment des informations de leur environnement, et parfois elles réagissent de manière à modifier l'environnement."
Cette complexité est payante pour Vibrio de plusieurs manières. En modifiant leur cycle de vie pour inclure un stade multicellulaire, les bactéries peuvent digérer efficacement l'alginate : leur nombre augmente et la coquille creuse aide à concentrer les enzymes. Pendant ce temps, la structure de la communauté empêche trop de cellules de naître. Les cellules de la coquille perdent la possibilité de se reproduire, mais leur ADN survit de toute façon à la génération suivante, puisque toutes les cellules de l'orbe sont des clones.
Quelle est la fréquence de la multicellularité ?
L'ouvrage est « un beau papier », selon Jordi van Gestel, qui étudie l'évolution du développement microbien au Laboratoire européen de biologie moléculaire et n'a pas participé à la recherche. Van Gestel dit que les résultats renforcent l'idée que, loin d'être l'exception, la vie en groupe microbien est la norme.
"Cela illustre magnifiquement la complexité du cycle de vie de bactéries aussi simples", a-t-il déclaré.
Anahit Penesian, microbiologiste à l'Université Macquarie en Australie, affirme que les travaux de Schwartzman et Cordero offrent un défi utile aux idées préconçues sur les bactéries. "C'est gravé dans notre compréhension qu'un microbe n'est qu'une seule cellule", a-t-elle déclaré, et par conséquent, les chercheurs ne recherchent souvent pas de comportements complexes qui pourraient dominer la vie microbienne. "C'est comme regarder une graine ou une spore de plante et essayer de déduire à quoi ressemble la plante entière."
Le nouveau système d’ Vibrio La découverte s'ajoute à une liste croissante de microbes qui peuvent devenir multicellulaires pendant au moins une partie de leur vie. L'année dernière, des chercheurs du Georgia Institute of Technology ont rapporté que les levures unicellulaires de leur laboratoire ont développé une énorme forme multicellulaire en seulement deux ans. Et en octobre, des chercheurs au Japon ont annoncé leur découverte de bactéries qui se développent en structures multicellulaires sur les parois des grottes ; lorsque les roches sont immergées par des cours d'eau souterrains, les structures éjectent des cellules spécialisées comme des graines pour coloniser d'autres endroits.
Schwartzman et van Gestel croient tous deux qu'une capacité de multicellularité a évolué tôt dans l'histoire de la vie et est partagée avec les anciennes cousines des bactéries, les archées, qui semblent également unicellulaires. Ils pensent que ce n'est qu'une question de temps avant que les chercheurs ne trouvent d'autres espèces aux propriétés similaires - et Schwartzman a déjà commencé à chercher.
James Shapiro, une microbiologiste à la retraite de l'Université de Chicago, ne doute pas qu'elle le trouvera.
À partir des années 1980, Shapiro et d'autres sommités de la microbiologie telles que Bonnie Bassler à l'Université de Princeton a montré que le mode de vie unicellulaire de bactéries bien étudiées était souvent un artefact des environnements de flacons artificiels dans lesquels elles étaient cultivées. Dans un article 1998 dans l' Revue annuelle de microbiologie, Shapiro a fait valoir que les bactéries ne sont pas des solitaires unicellulaires. "Je suis arrivé à la conclusion que fondamentalement, toutes les bactéries sont des organismes multicellulaires", a-t-il déclaré.
Au cours de ses quatre décennies de carrière, Shapiro a vu son hypothèse passer de presque hérétique à incontestable. "Au début, j'ai juste attiré l'attention perplexe, mais maintenant c'est devenu la sagesse conventionnelle", a-t-il déclaré. "La multicellularité est une propriété inhérente aux bactéries."
Note de l'éditeur : Cordero est co-directeur de la Simons Collaboration on Principles of Microbial Ecosystems. La recherche de Schwartzman, Cordero et leurs collègues a été soutenue grâce à cette collaboration par la Fondation Simons, qui parraine également ce magazine éditorial indépendant.