La thérapie par particules - traitement du cancer utilisant des faisceaux de protons ou d'ions plus lourds - fournit une administration de dose hautement conforme et une plus grande épargne des tissus normaux que la radiothérapie conventionnelle à base de photons. Mais pour les survivants à long terme du cancer, le risque de cancer secondaire radio-induit (SC) est important et doit être pris en compte lors du choix de leur modalité de traitement.
Les données épidémiologiques étant rares pour les nouveaux traitements tels que la protonthérapie et la thérapie par ions carbone, une équipe dirigée au Centre GSI Helmholtz pour la recherche sur les ions lourds développe un modèle pour comparer les risques de CS entre les modalités de thérapie par particules. Le modèle décrit par Antonia Hufnagl et collègues de Physique médicale, pourraient finalement être intégrés dans les systèmes de planification de traitement pour inclure le risque SC comme critère d'optimisation supplémentaire.
Événements mortels versus cancérigènes
Les modèles de risque SC fonctionnent généralement en tenant compte de l'équilibre entre la destruction cellulaire (conduisant à la suppression du cancer) et la transformation cellulaire (induction de mutations qui conduisent éventuellement au cancer). La probabilité qu'un volume irradié développe un cancer est définie à l'aide du modèle linéaire-quadratique (LQ), qui fournit une relation simple entre la survie cellulaire et la dose de photons délivrée.
Dans cette étude, les chercheurs ont utilisé le modèle à effet local (LEM) pour prédire l'efficacité biologique relative (EBR) de l'induction SC après une thérapie par particules. Pour tenir compte de l'augmentation de l'EBR du rayonnement des particules, ils ont remplacé les paramètres LQ des photons dans le modèle de risque par les paramètres LQ du faisceau ionique prédits par le LEM. Une caractéristique clé de leur approche est l'utilisation du LEM à la fois en termes de destruction cellulaire et d'induction du cancer.

"La double utilisation du LEM reflète la concurrence entre les deux processus majeurs déterminant le développement du SC, à savoir la transformation cellulaire et la destruction cellulaire", explique l'auteur principal Michel Schotz. «Avec une dose et / ou une efficacité croissantes, la destruction des cellules peut supprimer la viabilité des cellules transformées. Cela conduit à une interaction complexe, qui ne peut pas être simplement reflétée autrement dans une procédure en une seule étape.
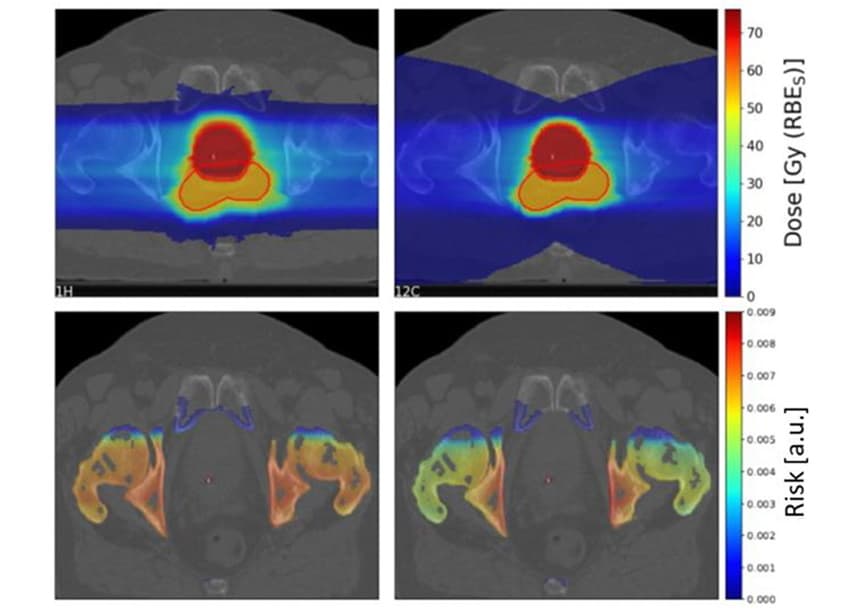
Pour étudier les facteurs qui influent sur le risque SC, les chercheurs ont utilisé le système de planification TPS TRiP98 pour générer des plans de traitement aux ions carbone et aux protons biologiquement optimisés basés sur une géométrie idéalisée. Les plans irradiaient une cible de 4x4x4 cm avec un seul faisceau de particules ou deux faisceaux opposés, avec un organe à risque (OAR) de 4x4x1 cm devant la cible. En raison des incertitudes dans les paramètres LQ des photons utilisés comme données d'entrée pour le LEM, ils ont estimé les rapports de risque proton-ion carbone, plutôt que les valeurs de risque individuelles.
Pour ces configurations idéales, le modèle n'a pas montré de préférence claire pour les protons ou les ions carbone, mais a révélé une dépendance complexe à divers paramètres. La diffusion latérale réduite des ions carbone conduit à un risque SC inférieur à celui des protons dans le canal d'entrée. Cependant, les ions carbone déposent une dose plus élevée derrière la cible en raison de la queue de fragmentation, augmentant le risque de SC pour les OAR derrière la tumeur après irradiation aux ions carbone.
Pour les plans à faisceau unique, le risque SC total était environ 1.5 fois plus élevé pour les ions carbone que pour les protons. Avec deux faisceaux opposés, le risque total de SC était 1.16 fois plus élevé pour les protons, bien que cela variait fortement en fonction de la localisation spatiale du volume sensible supposé par rapport au volume cible.
La radiosensibilité tissulaire (aux photons) a eu un impact majeur sur le rapport de risque SC, les OAR radiorésistants bénéficiant d'un traitement aux ions carbone et les OAR sensibles aux faisceaux de protons. En revanche, le schéma de fractionnement a eu peu d'impact sur les valeurs de risque attendues.
Géométrie du patient
Pour étudier des scénarios cliniques, Scholz et ses collègues ont estimé les risques de SC pour 10 patients atteints d'un cancer de la prostate précédemment traités par radiothérapie photonique à l'hôpital universitaire de Karolinska. Ils ont généré des plans de traitement pour les patients en utilisant deux champs de protons et d'ions carbone balayés latéralement.
Comme vu précédemment, la queue de fragmentation des ions carbone a entraîné une grande zone à faible dose derrière la cible. Cependant, la région cible à haute dose était plus conforme pour l'ion carbone que pour les plans protons.
L'équipe a calculé les rapports de risque SC proton-ion carbone pour quatre OAR (vessie, rectum, os et peau) pour les 10 patients. Pour les os et la peau, les plans protons ont donné un risque SC légèrement plus élevé que les plans ions carbone, avec des ratios de risque médians de 1.19 et 1.06 pour les os et la peau, respectivement. Pour la vessie et le rectum, cependant, les plans de proton ont entraîné des risques de SC significativement plus faibles, avec des risques relatifs de 0.68 et 0.49 pour la vessie et le rectum, respectivement.
Les chercheurs concluent que les connaissances acquises par ce modèle pourraient aider à optimiser les futurs traitements. Actuellement, la modélisation du risque relatif convient principalement comme outil de comparaison de différents scénarios de traitement pour différentes cohortes de patients. Mais Scholz note que l'intégration de tels modèles dans la planification du traitement pour les patients individuels serait simple.

La thérapie par grille d'ions carbone épargne les tissus sains
"Il suffit d'exécuter la planification pour une distribution de dose donnée avec deux ensembles de paramètres biologiques différents représentant respectivement la destruction cellulaire et le processus de transformation cellulaire", explique-t-il. "Ensuite, seul un post-traitement des distributions d'effets 3D résultantes avec des outils mathématiques standard est nécessaire pour dériver les distributions de rapport de risque correspondantes."
La prochaine étape, dit-il, consiste à valider le modèle par comparaison avec des données cliniques. "Étant donné qu'à l'heure actuelle, ces données sont rares, l'extension de l'approche pour inclure également les traitements par photons et la détermination des rapports de risque correspondants des protons par rapport aux photons et des ions carbone par rapport aux photons serait une prochaine étape importante", a déclaré Scholz. Monde de la physique.