Rick Jeune est professeur de biologie au MIT qui étudie l'ARN transcrit à partir de la partie du génome qui ne code pas pour les protéines, appelée ADN non codant. Cette partie du génome était autrefois appelée « ADN indésirable », ce qui vous donne une idée de ce que beaucoup pensaient de sa valeur. Les scientifiques ont été surpris de découvrir qu’il représente 98 % du génome humain, ce qui a déclenché une quête pour découvrir ses fonctions.
Dans cette conversation, Rick Young discute avec Hanne Winarski de Bio Eats World et du commandité a16z Jorge Condé, qui dirige les investissements à l'intersection de la biologie, de l'informatique et de l'ingénierie. Avant de rejoindre a16z, Condé était directeur de la stratégie chez Syros Pharmaceuticals et a cofondé la société d'interprétation génomique Knome.
La conversation couvre ce que nous avons appris sur ces 98 % du génome que nous pensions être inutiles. Il s’avère que ses tâches sont diverses, allant de la dissimulation des preuves d’infections virales anciennes à la création de chaque visage unique. Ils discutent également de son rôle massif mais encore mal compris dans la maladie, et de la façon dont l’étude de l’ADN indésirable a conduit à la découverte d’un interrupteur marche/arrêt du gène auquel personne ne s’attendait.
Remarque : cette conversation a été initialement publiée sous forme d'épisode de Bio mange du monde. Vous pouvez écouter cet épisode ici.
HANNE WINARSKY : Nous sommes ici aujourd'hui pour parler de ce qu'on appelle l'ADN indésirable. Pouvons-nous commencer par une simple définition ?
RICK YOUNG : C'est un terme vieux d'environ un demi-siècle. Les scientifiques connaissaient des parties du génome qui ne codent pas pour les protéines, et ils théorisé que c'était de la camelote. Nous savions qu’une partie n’était que les restes d’anciennes invasions virales du génome. Mais cette expression, ADN indésirable, nous a hantés.
HANNE : Alors, quel est le terme que vous essayez d'utiliser à la place ? La matière noire de l’ADN que nous comprenons mieux chaque jour ?
RICK : ADN non codant.
HANNE : Pourquoi les considéraient-ils comme des détritus ? Vous avez mentionné qu'une partie était constituée d'anciens fragments de virus. Mais pourquoi n’était-ce pas un mystère dès le début ?
RICK : Parce que tout au long de l’histoire biologique, il y a eu ce débat sur ce qu’était le matériel génétique, et au départ, on pensait qu’il s’agissait de protéines. Mais une fois qu’il est devenu clair que les protéines étaient la machinerie et que l’ADN était le modèle de la machinerie, les gens se sont occupés de la machinerie parce que les défauts de la machinerie provoquent des maladies. Mais il s’est avéré que seulement 2 % du génome code pour les acides aminés des protéines. La grande majorité, 98 %, ne le fait pas. Et en 2000, lorsque les scientifiques du Projet Génome Humain présenté la séquence du génome humain, ces données ont confirmé que 98 % de nos 3.2 milliards de bases ne codent pas pour des protéines.
Chaque gène a cette capacité remarquable de prendre des morceaux de segments de la protéine qu'il va coder et de les arranger de manière à ce que le produit que vous obtenez dans une cellule puisse fonctionner un peu plus rapidement, ou dans une autre cellule, puisse en fait aller dans une cellule différente. compartiment pour faire un travail différent.
JORGE CONDE : Quelles étaient les estimations initiales du nombre de gènes qui seraient codés dans ces 3.2 milliards de paires de bases ?
RICK : Nous avons opté pour environ 100,000 XNUMX. Nous avons simplement supposé que plus nous sommes complexes, plus le génome est grand et plus le nombre de gènes est grand. Nous avons été un peu choqués lorsque nous avons réalisé que nous et les insectes possédons à peu près le même nombre de gènes.
JORGE : Moins de gènes que prévu codant pour ce que nous considérons comme un organisme incroyablement complexe, n'est-ce pas ?
HANNE : C’est un peu un choc.
Même code source, programmes différents
JORGE : Une chose que nous avons tous apprise au lycée, c'est que les codes ADN pour l'ARN, les codes ARN pour les acides aminés et les acides aminés nous donnent des protéines, n'est-ce pas ? C'est le dogme central de la biologie moderne.
RICK : Oui. L'une des principales raisons pour lesquelles les gens ont été prompts à attribuer le titre d'« ADN indésirable » à ces 98 % du génome qui ne codent pas pour les protéines est qu'on pensait, en grande partie, que l'objectif commercial du génome était de fabriquer des protéines. protéines.
JORGE : Alors, quand les généticiens ont-ils commencé à comprendre que l’ADN indésirable pourrait être plus que de la cochonnerie ?
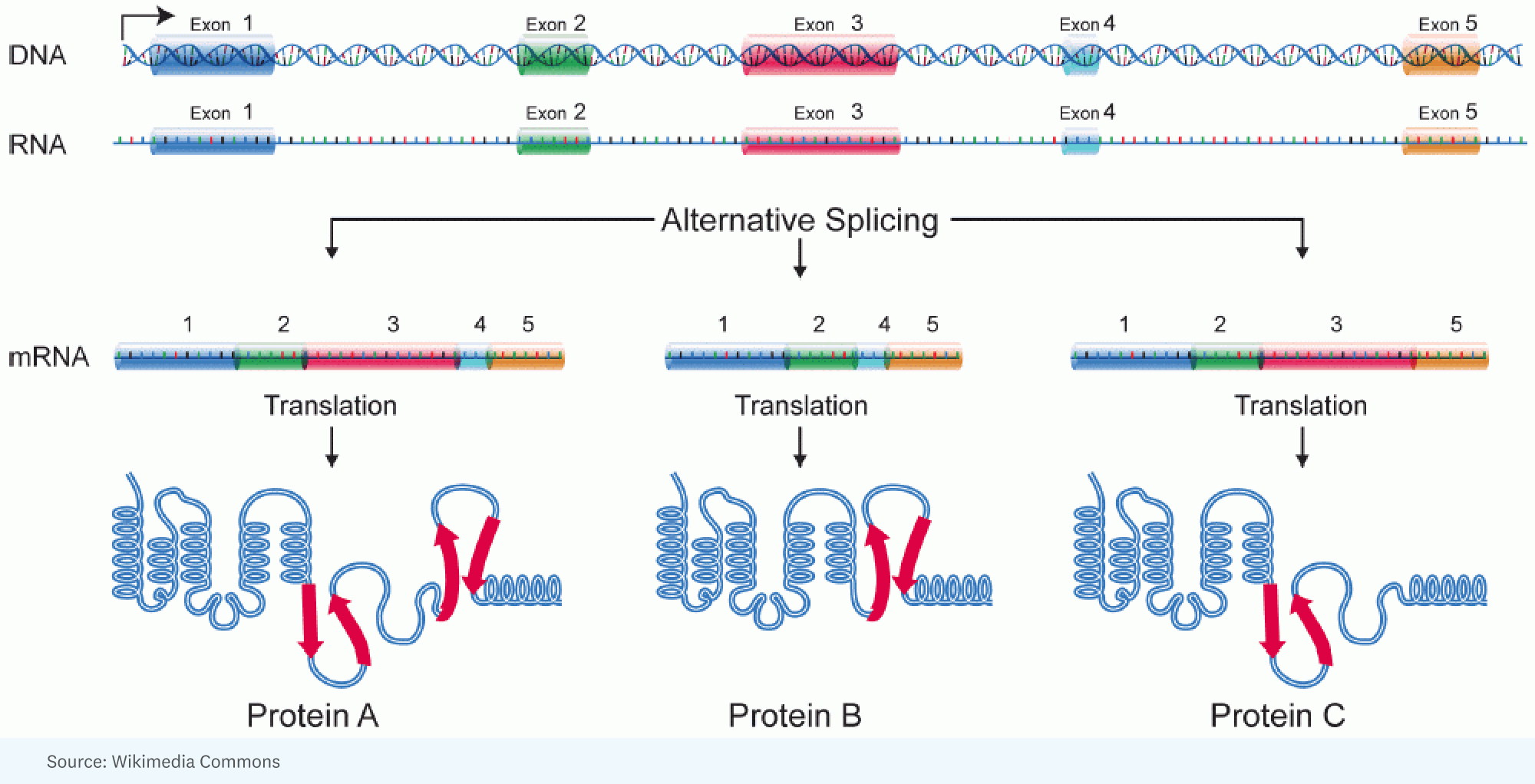
RICK : [Cela a commencé avec] la prise de conscience qu'il était possible de rendre compte de la complexité supplémentaire entre les êtres humains et les insectes grâce à une énorme quantité d'épissages alternatifs. C'est là que vous avez, pour un seul gène, un gros ARN qui est produit, mais il est épissé différemment dans une cellule par rapport à une autre cellule. En d’autres termes, différentes parties du gène se retrouvent dans la molécule d’ARN qui va spécifier la protéine. La protéine est donc un peu différente.
HANNE : Cela ressemble un peu à un kaléidoscope avec la lumière qui frappe différemment, vous obtenez des couleurs différentes, des angles différents.
RICK : Eh bien, et c'est une analogie intéressante. Je pense qu'une meilleure analogie serait lorsque vous avez ces Legos, et que vous pouvez fabriquer une machine, mais vous pouvez la fabriquer de tellement de manières différentes, avec tellement de structures et de couleurs différentes. Chaque gène a cette capacité remarquable de prendre des morceaux de segments de la protéine qu'il va coder et de les arranger de manière à ce que le produit que vous obtenez dans une cellule puisse fonctionner un peu plus rapidement, ou dans une autre cellule, puisse en fait aller dans une cellule différente. compartiment pour faire un travail différent.
JORGE : Chaque cellule d’un être humain donné possède à peu près le même génome. Pourtant, ce même génome donne naissance à un éventail incroyablement diversifié de types de cellules différents. Et donc dans la mesure où nous allons faire une analogie, chaque type de cellule exécute un programme différent à partir du même code source.
RICK : C’est vrai.
Les fonctions des 98%
JORGE : Vous n'avez pas besoin d'être un expert pour examiner différents types de cellules et voir à quel point ils peuvent être variés, n'est-ce pas ? Un neurone a une apparence très, très, très différente et fonctionne très, très différemment d’une cellule musculaire, par exemple. Qu’est-ce qui détermine le programme, le programme génétique qu’une cellule choisit d’exécuter ? Qu’est-ce qui fait d’une cellule musculaire une cellule musculaire et qu’est-ce qui fait d’un neurone un neurone ?
RICK : Nous avons donc commencé avec l’ADN qui fabrique l’ARN et [l’ARN] qui fabrique les protéines. C'est le dogme central. Mais il y a environ un demi-siècle, les scientifiques ont commencé à avancer l’argument selon lequel l’ARN commençait en fait à créer tout seul divers types de fonctions. Et il s’avère que l’ARN possède en fait une partie de cette activité dès les premiers stades de développement.
Lorsque le spermatozoïde rencontre l’ovule, c’est l’ARN de la mère qu’elle introduit dans cet ovule. Il existe des molécules d’ARN qui font cela. Il s’avère que les antibiotiques que nous utilisons régulièrement se lient à l’ARN. L’ARN y joue donc un rôle assez important. Cela a changé la façon de penser des gens. Ensuite, lorsque nous avons commencé à réfléchir à l’ADN indésirable, il s’agit de la partie de l’ADN qui ne code pas pour les protéines. Eh bien, et si le monde était basé sur l'ARN et non sur les protéines, du moins au niveau début? Et maintenant, nous comprenons qu’une grande partie de ce que nous appelons l’ADN indésirable, ou ce que nous appelions autrefois l’ADN indésirable, n’est pas indésirable. C'est hautement fonctionnel. Et la majeure partie produit de l’ARN.
Ainsi, votre objectif dans la programmation d’une cellule est d’utiliser uniquement cet ensemble spécifique de séquences qui ajusteront chacun de cet ensemble commun de gènes au niveau souhaité. . . .Notre problème est que nous ne connaissons pas réellement le programme.
HANNE : Waouh. Pouvez-vous nous faire un petit aperçu de la situation actuelle dans la compréhension de la partie non codante de l'ADN ? Vous savez, quelle est notre compréhension actuelle de toutes les différentes possibilités qui existent ?
RICK : Seulement 2 % de notre génome code pour ces séquences d'acides aminés qui entrent dans les protéines. Alors, qu'y a-t-il dans le grand livre de notre comptable pour ce que fait le reste ?
Environ la moitié de notre génome est ce que nous appelons l’hétérochromatine. C'est là que vous obtenez les produits d'anciennes invasions virales. D'anciens rétrovirus ont envahi, puis ont été transformés en ADN et insérés dans le génome. C'est donc en fait un moyen que nous avons eu tout au long de notre histoire évolutive pour cacher des séquences que nous ne voulons pas traiter. Et il reste silencieux dans notre génome, à une exception importante près.
L’autre moitié est l’endroit où se trouvent tous les gènes actifs codant pour les protéines et où se trouvent tous les gènes actifs non codants. Alors, qu'est-ce que ça fait ? Il a une longue liste de fonctions réglementaires, mais je vais la simplifier en trois.
L'une de ses fonctions est le maintien des chromosomes. Ce sont donc les endroits où se produit la réplication de l’ADN. Ce sont les sites de notre génome qui sont responsables de son repliement car il s'agit d'un polymère de 2 mètres de long. Il doit être replié en un noyau de quelques microns de diamètre.
La deuxième région de régulation regroupe toutes ces choses qui sont responsables de la régulation des gènes. Il est probable que le génome spécifie dans une plus grande mesure les caractéristiques régulatrices de l'expression des gènes que les gènes eux-mêmes. Et c’est parce que chaque cellule utilise une région régulatrice différente pour chaque gène.
HANNE : C'est tellement intéressant, j'ai l'impression qu'il y a un placard avec des étagères contenant des choses que nous devons mettre dans le placard pendant un petit moment, et puis il y a le placard d'infrastructure.
Pourquoi est-il important de se concentrer autant sur cela ? Parce que c’est là que se produisent plus de 75 % de toutes les variations génétiques associées aux maladies.
RICK : Oui. Fondamentalement, vous disposez d’un ensemble commun de gènes dans chaque cellule, à la fois codants et non codants. Et vous avez des éléments, vous avez des séquences réelles qui fonctionnent uniquement dans des types de cellules spécifiques. Ainsi, votre objectif dans la programmation d’une cellule est d’utiliser uniquement cet ensemble spécifique de séquences qui ajusteront chacun de cet ensemble commun de gènes au niveau souhaité. Vous jouez donc d'un instrument de musique étonnant composé de 20,000 XNUMX gènes codant pour des protéines et d'environ le même nombre de gènes non codants. Vous faites cela à travers des séquences spécifiques. Notre problème est que nous ne connaissons pas réellement le programme.
Dévoiler le programme de réglementation
HANNE : Alors, comment commencez-vous à réfléchir ? Quels sont les conseils que vous suivez lorsque vous commencez à essayer de comprendre ce programme ?
RICK : Il semble que les régions régulatrices de chaque gène dans une cellule s'affichent elles-mêmes. Ils vous le disent. Et vous pouvez utiliser diverses technologiesCela vous indique très rapidement, sur l'ensemble du génome, dans un type de cellule particulier, disons dans un motoneurone, quelles sont toutes les régions régulatrices actives dans cette cellule. Vous pouvez même voir où est réglé le rhéostat pour chacun de ces gènes. C'est là que le séquençage rapide nous a donné la capacité de déduire simultanément tous les éléments actifs des gènes, codants et non codants dans le génome d'un type cellulaire particulier.
Notre problème pour le moment est que vous devez faire cela un type de cellule à la fois, et nous avons plusieurs centaines de types de cellules. Parfois, il est difficile de voir une cellule particulière sans la contaminer par d’autres cellules, car tous nos tissus sont en réalité des combinaisons de plusieurs types de cellules.
JORGE : Cela vaut-il la peine de débattre par analogie si nous disions que, étant donné que chaque cellule possède le génome entier, chaque cellule possède le recueil de chansons complet, des types de cellules spécifiques choisissent de jouer des symphonies spécifiques et que la machinerie qui aide à réguler le génome est essentiellement le conducteur de l'orchestre? Cette machinerie est le chef d’orchestre qui détermine quelles chansons jouer, quelles notes frapper, à quel volume les frapper, à quel tempo, etc. Est-ce une analogie raisonnable pour comprendre la fonction régulatrice du génome ?
RICK : Dans le sens où il est facile de voir quel serait le résultat. Mais ce qui est plus difficile, c'est de savoir qui rédige toutes les notes ? Qui est le compositeur qui a mis toutes ces notes là-dedans et qui a réussi à tout faire ? Le compositeur s'avère être, pour la plupart de nos cellules et la plupart de nos gènes, ces molécules protéiques appelées facteurs de transcription, dont le rôle est de se lier aux éléments régulateurs des gènes, et de leur donner une mise en rhéostat.
Il y a là un problème intéressant, car aux sites où ces facteurs de transcription se lient, nous les appelons un activateur. Sur ces sites amplificateurs, il y a aussi toujours un ARN fabriqué à partir du site où ils sont liés. Nous n’avons compris que récemment que cet ARN joue un rôle important dans la régulation. Juste pour amplifier cela : la façon dont votre iPhone reconnaît votre visage est due au fait que les amplificateurs qui contrôlent les gènes de la structure crânienne du visage varient chez chaque être humain.
Ce que vous avez maintenant ici, c'est ce triumvirat. Vous avez la séquence d'ADN. Il est reconnu spécifiquement par la molécule qui le compose, le facteur de transcription, mais il a besoin de ce troisième élément, cette molécule d'ARN. Ainsi, l’ADN, l’ARN et les protéines travaillent ensemble dans ces régions régulatrices. Et pourquoi est-il important de se concentrer autant sur cela ? Parce que c’est là que se produisent plus de 75 % de toutes les variations génétiques associées aux maladies.
HANNE : Je ne veux pas devenir trop ringard musicalement, mais cela ressemble presque à un accord, non ? La structure à trois notes joue ensemble pour créer quelque chose de plus grand.
RICK : C’est vrai.
Les programmeurs
JORGE : L’un des domaines les plus avant-gardistes de la biologie est notre capacité croissante à essayer de comprendre certaines des lois régissant la façon dont les programmes cellulaires sont déterminés, dont le destin cellulaire est déterminé. Pour moi, l'un des progrès fascinants dans notre compréhension est venu du travail réalisé par Yamanaka, pour lequel il a reçu le prix Prix Nobel, démontrant que l’on pouvait reprogrammer des types de cellules en les exposant simplement à une très petite poignée de facteurs de transcription spécifiques.
HANNE : Pouvez-vous décrire exactement pourquoi cela a constitué une telle avancée dans le domaine ?
RICK : J’ai joué un tout petit rôle dans ce film. Il s'avère que même si ce nombre est très important, un petit nombre de facteurs de transcription peuvent identifier tous les éléments régulateurs essentiels à l'identité de cette cellule. Et Yamanaka nous l'a prouvé en montrant que seuls quatre de ces facteurs pouvaient être utilisés pour programmer n'importe quelle cellule humaine, ou n'importe quelle cellule mâle, en l'équivalent d'une cellule souche embryonnaire.
Une façon d’y penser est que si la chanson est trop mauvaise, l’organisme ne vit pas. Mais si c'est juste un peu décalé, vous grandissez, vous devenez adulte, et puis vous contractez toutes ces diverses maladies à mesure que nous vieillissons.
JORGE : Et c'est incroyable, n'est-ce pas ? Parce que cela suggérerait que le système est conçu d’une manière ou d’une autre de manière à tirer une incroyable complexité de ce qui semble être une simplicité. Quatre facteurs de transcription déterminant toute la cascade complexe d’événements qui régissent les différents types de cellules.
Certains des travaux que vous avez effectués ont démontré que ces facteurs de transcription maîtres établissent essentiellement l'équivalent de circuits qui contrôlent les gènes nécessaires à l'établissement et au maintien d'un état cellulaire. Pouvez-vous décrire ce que vous entendez par circuits de contrôle génétique ?
RICK : Il y a deux éléments intéressants dans les circuits de contrôle génétique. La première est que lorsqu'un régulateur principal trouve ces activateurs et provoque l'expression de ses gènes cibles, cela fait partie du circuit, c'est le résultat. L’autre élément qui est vraiment intéressant est que les facteurs de transcription maîtres régulent également leur propre expression. Il y a donc une boucle de rétroaction. Par exemple, vous auriez un schéma électrique dans lequel les maîtres contrôlent leur propre expression à partir de leurs propres gènes, puis se lient et contrôlent l'expression d'un ensemble cible de gènes.
JORGE : C’est assez sauvage. C'est presque comme une référence circulaire, où les facteurs de transcription sont des protéines, cette protéine est fabriquée à partir d'ADN, codé dans un gène. Les facteurs de transcription font partie de la machinerie qui facilite l’expression des gènes dans la transcription. Vous dites donc que les facteurs de transcription – les protéines – aident à réguler l'expression des gènes qui fabriquent les facteurs de transcription.
HANNE : Ouais. Il y a une image mentale de toute cette symphonie de toutes ces petites cellules, vous savez, chantant toutes ces différentes textures.
Le génome régulateur et la maladie
HANNE : Qu'est-ce que cela change lorsque nous commençons à comprendre comment tout cela fonctionne ? Que pouvons-nous faire avec ces connaissances ?
RICK : Ces sites où ces facteurs de transcription principaux déterminent l'identité de chaque cellule sont ceux où se trouvent la plupart des variations humaines qui causent la maladie. Plus de 75 % des variations associées à la maladie se produisent dans ces éléments activateurs qui pilotent les gènes clés.
JORGE : D’accord. Alors c'est fou, non ? Lorsque nous pensons aux mutations causant ou contribuant à une maladie, nous pensons normalement à une mutation qui se produit dans un gène qui affecte la protéine, brise la protéine d’une manière ou d’une autre et donne naissance à une maladie.
HANNE : C’est vrai.
JORGE : Mais vous dites que dans 75 % des cas, cette mutation se produit en réalité en dehors des gènes, elle se produit dans cette région non codante du génome. Si le gène est la chanson, ce n'est pas que la chanson soit mal jouée, c'est qu'elle peut être jouée trop fort, ou trop doucement, ou trop lentement, ou trop rapidement, mais c'est ce qui entraîne beaucoup de maladies.
RICK : En fait, une façon d'y penser est que si la chanson est trop mauvaise, l'organisme ne vit pas. Mais si c'est juste un peu décalé, vous grandissez, vous devenez adulte, et puis vous contractez toutes ces diverses maladies à mesure que nous vieillissons.
Pour la première fois, nous disposons de tous ces modèles expliquant comment configurer l’appareil et le faire fonctionner.
JORGE : Il ne s'agit pas de créer la mauvaise version du gène, mais d'obtenir le mauvais dosage du gène. Trop ou pas assez.
RICK : C’est exact. Comment trouvez-vous des thérapies pour résoudre ce problème ? Comment ajuster ou atténuer sélectivement le gène ? En principe, nous pouvons y parvenir de nombreuses manières, notamment grâce à la thérapie génique. Nous pouvons le faire grâce à l’édition génétique CRISPR. Mais la chose la plus importante que nous ayons découverte ces dernières années, je pense, est que chacun de ces éléments régulateurs des gènes possède un ARN. L'ARN est fonctionnel. C'est un rhéostat qui aide à régler la production de ce gène. Il existe désormais de nombreuses façons de ARN de médicaments. Nous avons OLS (oligonucléotides antisens), comme Spinraza pour l'amyotrophie spinale. Nous avons une interférence ARN. Nous avons de nouveaux médicaments à petites molécules à l’horizon. Si vous pouviez réfléchir aux moyens de programmer un médicament, un ARN synthétique, pour réguler l'ARN régulateur, l'ARN régulateur, vous disposez du principal moyen de régler n'importe quel gène dans n'importe quelle cellule où cette cellule peut accéder à ce médicament.
HANNE : Il ne s’agit donc pas simplement d’une compréhension totalement différente de la manière dont la maladie apparaît. Mais il s’agit d’une toute autre compréhension de la manière dont nous pourrions potentiellement traiter la maladie.
RICK : Exactement. En principe, nous disposons désormais d’un moyen programmable de développer un médicament capable d’ajuster n’importe quel gène d’intérêt. À l’heure actuelle, les gens programment simplement des molécules d’ARN synthétiques pour produire un vaccin contre cette pandémie. C’est le résultat le plus efficace auquel on puisse s’attendre pour un vaccin.
JORGE : Quand nous pensons aux applications de technologie en biologie, nous essayons généralement de faire l'une des deux choses suivantes. Soit nous essayons d'interroger la biologie très en profondeur et de la comprendre, en augmentant les niveaux de sa complexité, soit nous essayons d'intervenir. Nous sommes de plus en plus capables d’interroger la biologie à un niveau très, très profond afin de comprendre les lois qui régissent ou les règles régissant la manière dont les cellules sont régulées. Et on a ça, on a des outils de plus en plus sophistiqués, comme ceux-là modalités programmables de médecine, où nous pouvons cibler l’ARN de manière très, très spécifique. Ce sera en quelque sorte ce cercle vertueux entre notre capacité à interroger la biologie et ensuite à intervenir de manière de plus en plus sophistiquée. Et je pense que c’est l’un des aspects les plus passionnants de la situation actuelle dans ce domaine.
RICK : Je suis d’accord avec toi. Nous développons actuellement une compréhension si profonde des multiples niveaux de complexité que nous pouvons proposer des hypothèses thérapeutiques que nous n’avons jamais vues auparavant. Nous pouvons les réaliser à une vitesse que nous n’aurions jamais imaginée il y a seulement quelques années. La distance temporelle entre une découverte fondamentale et la thérapie appliquée aux patients il y a 10 ans était en moyenne de 14 ans. Il est désormais concevable d'envisager de développer une hypothèse thérapeutique basée sur la science fondamentale et une thérapie qui parviendrait au patient en neuf mois. Étaient vu que avec ce nouveau vaccin.
HANNE : Il s’agit donc de changer non seulement la façon dont nous comprenons l’émergence des maladies, la façon dont nous les traitons, mais aussi la manière dont nous effectuons la science elle-même, puis la rapidité avec laquelle la science peut se produire et se transformer en réalité clinique pour les patients.
L'ARN comme compartimenteur
RICK : Exactement. Mais maintenant, il y a la cerise sur le gâteau car, classiquement, nous avons pensé la pharmacologie de deux manières. L’un d’entre eux était l’effet de la drogue sur l’individu. L’autre était l’effet de l’individu sur la drogue. Et dans ce dernier segment, vous vous inquiétez de la distribution du médicament, des tissus auxquels il est destiné, des tissus auxquels il n'est pas disponible. Parce que nous supposons simplement qu’une fois qu’un médicament pénètre dans une cellule, il se diffuse à travers la cellule et trouve sa cible. Nous avons des compartiments reliés par des membranes, que nous connaissons depuis un siècle.
JORGE : Quelle a toujours été la question de la perméabilité cellulaire, n'est-ce pas ? Peut-il traverser la membrane ?
RICK : Oui. Peut-il traverser une membrane et pénètre-t-il ou non dans le noyau ? Mais nous n'avons compris qu'au cours de la dernière décennie qu'il existe également de nombreux corps non membranaires dans les cellules, appelés condensats biomoléculaires car on pense que l’une des raisons pour lesquelles ces corps se forment est qu’ils se condensent un peu comme l’eau se condense en une goutte de rosée. Mais ce qui est si profond dans cette compréhension, c’est que ces condensats compartimentent les protéines, l’ADN et l’ARN pour des fonctions spécifiques. Nous comprenons maintenant qu'il est possible de séparer les 5 à 10 milliards de molécules de protéines et d'ARN d'une cellule en différents compartiments où elles fonctionnent avec leurs camarades.
HANNE : Hein.
JORGE : Sommes-nous en train de quitter le domaine de la biologie et d’entrer dans le domaine de la physique ?
RICK : Nous avons fait exactement cela parce que la séparation des phases est considérée comme la force motrice. C'est un phénomène physique décrit par les mathématiques.
HANNE : Waouh.
RICK : Maintenant, nous avons appris que les médicaments chimiothérapeutiques les plus efficaces sont se concentrer à l'intérieur des compartiments où vivent leurs cibles. Ils se concentrent 600 fois sur le reste de la cellule, ils ont donc une activité ciblée sur les oncogènes qui est 600 fois supérieure à celle attendue. Cela nous indique non seulement qu’il existe de toutes nouvelles connaissances importantes pour la découverte et le développement de médicaments pour l’avenir, mais cela nous donne également envie de mieux comprendre le rôle de ces condensats.
Voici ce que j’entends par cerise sur le gâteau. Ce que nous avons réalisé, c'est que ces compartiments de condensat qui fonctionnalisent la cellule de manière si importante sont régulés par l'ARN. Leur formation peut être stimulée par l'ARN. Si vous produisez trop d’ARN, vous portez le rhéostat à 11, il va dissoudre un condensat. Alors, tout à coup, nous réalisons que la production d’ARN sur n’importe quel site à l’intérieur d’une cellule peut régler la fonction de n’importe quoi en améliorant ou en dissolvant les condensats là où cette fonction se produit. Et c'est, je pense, profond, car c'est une autre manière d'utiliser un ARN programmable, une molécule d'ARN synthétique, pour régler le fonctionnement d'une cellule devenue dysfonctionnelle. Pour la première fois, nous disposons de tous ces modèles expliquant comment configurer l’appareil et le faire fonctionner.
HANNE : Un autre bouton à composer.
RICK : Mais alors, comment l'éteignez-vous ? Il s’avère que lorsque vous produisez ce long ARN, cela ne constitue qu’une grande chaîne de charges négatives, qui dissout le condensat et arrête le gène. C'est ainsi que les gènes sont régulés. Vous ajustez le condensat avec un ARN, puis vous l'arrêtez avec le produit ARN créé lorsque le gène est entièrement transcrit.
HANNE : Super cool. Donc un interrupteur marche/arrêt, vraiment.
RICK : C'est un interrupteur marche/arrêt que personne n'avait prévu. Et cela signifie, encore une fois, que si vous disposez d’un médicament programmable, vous disposez d’une nouvelle façon de cibler les fonctions cellulaires dysfonctionnelles, d’une nouvelle solution à un problème thérapeutique.
JORGE : L’ADN indésirable d’un homme est la machinerie sophistiquée de régulation du génome d’un autre homme.
HANNE : Ou celle de tous les hommes.
Publié le 15 juillet 2022
La technologie, l'innovation et l'avenir, racontés par ceux qui l'ont construit.
- Andreessen Horowitz
- Bio & Sciences
- Bitcoin
- blockchain
- conformité de la blockchain
- conférence blockchain
- coinbase
- cognitif
- Consensus
- conférence cryptographique
- extraction de crypto
- crypto-monnaie
- Décentralisé
- DeFi
- Actifs numériques
- Ethereum
- machine learning
- jeton non fongible
- Platon
- platon ai
- Intelligence des données Platon
- Platoblockchain
- PlatonDonnées
- jeu de platogamie
- Polygone
- la preuve de la participation
- W3
- zéphyrnet