जीवित कोशिकाओं द्वारा निष्पादित कुछ कार्यों की नकल करने के लिए इंजीनियर की गई सिंथेटिक कोशिकाएं, जैव प्रौद्योगिकी और चिकित्सा में अनुप्रयोगों के लिए संभावनाएं रखती हैं। हालाँकि, सबसे छोटी जैविक कोशिकाएँ भी बेहद जटिल होती हैं और जीवित कृत्रिम कोशिकाओं के निर्माण में कई बाधाओं का सामना करना पड़ता है। शोधकर्ताओं में शुलमैन लैब जॉन्स हॉपकिन्स विश्वविद्यालय में हाल ही में इन चुनौतियों में से एक की दिशा में प्रगति हुई है: कोशिका सीमाओं के पार पदार्थ और सूचना का आदान-प्रदान।
में लेखन विज्ञान अग्रिम, शोधकर्ता - के सहयोग से काम कर रहे हैं अक्सिमेंटिएव समूह इलिनोइस विश्वविद्यालय अर्बाना-शैंपेन में - अभूतपूर्व दूरी पर इंजीनियर डीएनए नैनोचैनल के माध्यम से छोटे अणुओं के रिसाव-मुक्त परिवहन का प्रदर्शन करता है। भविष्य में, उनका काम कृत्रिम कोशिकाओं के निर्माण में मदद कर सकता है, और जीवित ऊतकों के अध्ययन और हेरफेर में भी सहायता कर सकता है।
बहुकोशिकीय जीवों के भीतर कोशिकाओं को अपने सामूहिक अस्तित्व को सुनिश्चित करने के लिए पदार्थ का आदान-प्रदान और संचार करने की आवश्यकता होती है। चूँकि प्रत्येक कोशिका एक लिपिड झिल्ली से घिरी होती है जो कई जैविक अणुओं के लिए अभेद्य होती है, विकास ने ऐसे तंत्र तैयार किए हैं जिनके द्वारा इस बाधा को पार किया जा सकता है। सिग्नलिंग रिसेप्टर्स, ट्रांसपोर्टर और छिद्र जानकारी रिले करते हैं और कोशिकाओं और उनके बाहरी हिस्से के बीच अणुओं के पारित होने की अनुमति देते हैं, जबकि गैप जंक्शन जैसे सेल संपर्क सीधे पड़ोसी कोशिकाओं के आंतरिक भाग को जोड़ते हैं और छोटे अणुओं के सेल-टू-सेल प्रसार को सक्षम करते हैं।
कृत्रिम प्रणालियों में इन प्रक्रियाओं की नकल करने के लिए, "शोधकर्ताओं ने एक दूसरे के बगल में स्थित सिंथेटिक कोशिकाएं विकसित की हैं जो अपने झिल्ली पर प्रोटीन छिद्रों के माध्यम से संचार कर सकती हैं" पहले लेखक यी ली, जिन्होंने अध्ययन का सह-नेतृत्व किया, बताते हैं। "हालांकि, सिंथेटिक सेल सिस्टम विकसित करना जहां कोशिकाएं लंबी दूरी तक संचार और सामग्री का आदान-प्रदान कर सकें, अभी भी एक चुनौती है।"
जीव विज्ञान में कोशिका-से-कोशिका संचार को सुविधाजनक बनाने वाली प्रोटीन संरचनाएं अमीनो एसिड से "नीचे से ऊपर" निर्मित होती हैं - उनके अनुक्रम में एन्कोड की गई जानकारी एक संरचना में तब्दील हो जाती है। एक अन्य जैविक मैक्रोमोलेक्यूल, डीएनए, का उपयोग मुख्य रूप से कोशिकाओं में सूचना भंडारण के लिए किया जाता है; लेकिन संश्लेषण में आसानी और उच्च-स्तरीय संरचनाएं बनाने की क्षमता के कारण, डीएनए नैनोटेक्नोलॉजी का क्षेत्र लगभग 30 साल पहले अपनी पहली अवधारणा-प्रूफ़ से कहीं आगे निकल गया है। तब से वैज्ञानिकों ने डीएनए ओरिगेमी नामक प्रयासों में डीएनए से अधिक परिष्कृत 2डी और 3डी संरचनाएं इकट्ठी की हैं, जिनमें जाली, ट्यूब, ज्यामितीय निकाय और यहां तक कि स्माइली चेहरों की कलात्मक प्रस्तुतिकरण भी शामिल हैं।
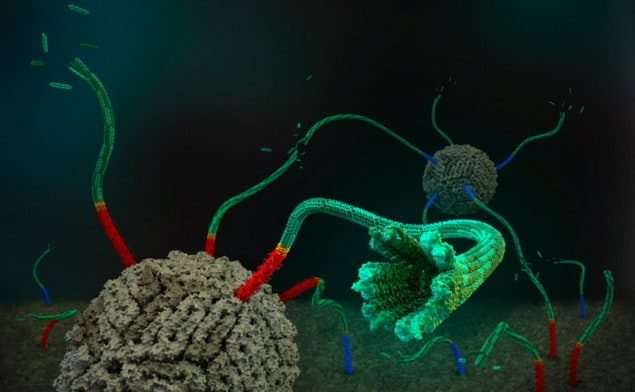
अपने अध्ययन में, शुलमैन लैब के शोधकर्ताओं ने डीएनए ओरिगामी नैनोपोर्स को संयोजित किया, जो कोशिका जैसी पुटिकाओं की झिल्लियों को पाटते हैं और अणुओं को पार करने के लिए छोटे-छोटे छिद्र बनाते हैं, इंजीनियर्ड सेल्फ-असेंबलिंग डीएनए नैनोट्यूब के साथ। पुटिकाओं में डाई अणु के प्रवाह की मात्रा निर्धारित करके, उन्होंने दिखाया कि छोटे नैनोपोर्स ने झिल्ली को डाई के लिए पारगम्य बना दिया। उन्होंने यह भी प्रमाणित किया कि इस परिवहन की गति प्रसार के अनुरूप है और पाया गया कि एक विशेष रूप से डिज़ाइन किया गया डीएनए कैप छिद्रों को अवरुद्ध कर सकता है और डाई को प्रवेश करने से रोक सकता है।

इसके बाद टीम ने इस काम को डीएनए नैनोट्यूब तक बढ़ाया, जिनकी औसत लंबाई 700 एनएम और अधिकतम 2 माइक्रोमीटर से अधिक थी। फिर, प्रयोगों से पता चला कि डीएनए संरचनाओं की उपस्थिति में डाई का प्रवाह बढ़ जाता है, और टोपी पारगम्यता को रोक सकती है। ली कहते हैं, निहितार्थ यह है कि "छोटे अणु बिना रिसाव के ट्यूबों से गुजर सकते हैं, और हम उम्मीद करते हैं कि प्रोटीन जैसे बड़े अणुओं को भी इन नैनोट्यूबों के माध्यम से ले जाया जा सकता है"।
अक्सिमेंटिव समूह के सदस्यों ने नैनोपोर-डाई प्रणाली के ब्राउनियन डायनेमिक्स कंप्यूटर सिमुलेशन का संचालन किया। इनसे पता चलता है कि एक सीमा आकार से नीचे के अणुओं के लिए, डीएनए ट्यूब की पार्श्व दीवार के माध्यम से रिसाव प्रवाह पर हावी होता है, जबकि बड़े अणुओं के लिए, अंत-से-अंत प्रसार पसंदीदा तंत्र बन जाता है।
ली बताते हैं कि ऐसे सिमुलेशन दो तरह से प्रयोगों के पूरक हैं। उनका कहना है, "शोधकर्ताओं को विशिष्ट कार्यों वाले नैनोस्केल संरचनाओं को डिजाइन करने में मदद करने के लिए डिज़ाइन टूल के रूप में उनका उपयोग किया जा सकता है", उदाहरण के लिए, "हमारे डीएनए नैनोस्ट्रक्चर के स्व-असेंबली कैनेटीक्स का अनुकरण करके", लेकिन वे "प्रयोगात्मक परिणामों को मान्य करने और प्रदान करने में भी मदद करते हैं।" भौतिक प्रक्रियाओं में अतिरिक्त अंतर्दृष्टि"।

स्वयं करें डीएनए डिज़ाइन
रेबेका शुलमैन - जिन्होंने अनुसंधान का सह-नेतृत्व किया - पाइपों की एक सादृश्यता बनाती है। “यह अध्ययन बहुत दृढ़ता से सुझाव देता है कि नैनोट्यूब का निर्माण करना संभव है जो स्व-संयोजन के लिए इन आसान तकनीकों का उपयोग करके लीक नहीं होता है, जहां हम एक समाधान में अणुओं को मिलाते हैं और बस उन्हें वह संरचना बनाने देते हैं जो हम चाहते हैं। हमारे मामले में, हम प्लंबिंग जैसा कुछ बनाने के लिए इन ट्यूबों को विभिन्न समापन बिंदुओं से भी जोड़ सकते हैं।
लैब के पास इन नैनोट्यूब के अनुप्रयोग के लिए महत्वाकांक्षी योजनाएँ हैं। “भविष्य के विकास में हमारे डीएनए नैनोट्यूब के साथ दो या दो से अधिक कृत्रिम कोशिकाओं को जोड़ना और उनके बीच आणविक परिवहन दिखाना शामिल है। हम संभावित रूप से दिखा सकते हैं [कि] एक कोशिका से सिग्नलिंग अणुओं का परिवहन दूसरे कोशिका में जीन अभिव्यक्ति को सक्रिय/निष्क्रिय कर सकता है," ली बताते हैं भौतिकी की दुनिया. टीम को यह भी उम्मीद है कि "सेल सिग्नलिंग व्यवहार का अध्ययन करने या दवा वितरण रणनीति विकसित करने के लिए, स्तनधारी कोशिकाओं को सिग्नलिंग अणुओं या चिकित्सीय की डिलीवरी को नियंत्रित करने के लिए नैनोट्यूब का उपयोग किया जाएगा"।