A termoradioterápia olyan rákkezelés, amelyben a hipertermiát – a daganat testhőmérséklet fölé melegítését – alkalmazzák a sugárterápia hatékonyságának fokozására. A javítás mértéke EQD-ben van kifejezveRT, az azonos terápiás hatás melegítés nélküli eléréséhez szükséges egyenértékű sugárdózis.
Klinikai vizsgálatok kimutatták, hogy ez a megközelítés lényegesen javíthatja a kezelési eredményeket számos daganattípus esetében anélkül, hogy növelné a normál szöveti toxicitást. Korábbi tanulmányok azt is kimutatták, hogy mind az elért hőmérséklet, mind a sugárterápia és a hipertermia között eltelt idő befolyásolja a klinikai kimenetelt.
Ennek a folyamatnak a részletesebb megértése és a kezelések optimalizálása érdekében a kutatók a Amszterdam UMC biológiai modellezést alkalmaztak a maximális hőmérséklet és időintervallum EQD-re gyakorolt hatásának vizsgálatáraRT. Megállapításaikat a International Journal of Radiation Oncology Biology Physics, arról számolnak be, hogy mind a magas hőmérséklet, mind a rövid időintervallumok elengedhetetlenek a terápiás hatás maximalizálásához.
Biológiai modell
A termoradioterápia elvégzéséhez a klinikusok rádiófrekvenciás vagy mikrohullámú készüléket használnak, hogy hetente egyszer vagy kétszer melegítsék a daganatot, akár a sugárterápiás kezelés előtt, akár után. A tumor hőmérsékletét 45°C alatt tartják, hogy megakadályozzuk a normál szövetek felmelegedését, de néha nemkívánatos (és fájdalmas) forró pontok is előfordulhatnak, amelyek korlátozzák a hipertermia kezelés során alkalmazható maximálisan tolerálható teljesítményszintet.
Első szerző Kok Petra és munkatársai szoftvert fejlesztettek ki a sugárterápia és a hipertermia biológiai hatásainak egyenértékű dóziseloszlások alapján történő modellezésére. A hipertermia által okozott DNS-javítás gátlását, valamint a közvetlen hő által kiváltott citotoxicitást figyelembe vevő modell lehetővé teszi a kombinált kezelési tervek minőségének értékelését standard dózis-térfogat hisztogramok segítségével.
Ahhoz, hogy alapvető betekintést nyerjen a hipertermiás paraméterek hatásába, a csapat először kiszámította a standard 23 × 2 Gy dóziseloszlás fokozását 37 és 43 °C közötti homogén hőmérsékletekkel, 0 és 4 óra közötti időintervallumokra.
A modell azt mutatta, hogy az EQDRT szignifikánsan nőtt mind a hőmérséklet emelkedésével, mind az időintervallum csökkenésével. Egy 1 órás időintervallumra például EQD-t jósoltRT 2–15 Gy-es emelkedés 39 °C-ról 43 °C-ra. Ezek az eredmények hangsúlyozzák a legmagasabb tolerálható tumorhőmérséklet elérésének fontosságát a klinikai kimenetel optimalizálása érdekében.
Az időintervallum hatása magasabb hőmérsékleten (41°C felett) volt a legkifejezettebb. Tipikus 41.5°C-os hipertermiás hőmérsékleten egy EQDRT kb. 10 Gy növekedést értek el 0 órás időintervallumban. Ez 4 órás időközönként 4 Gy körülire csökkent, ami azt jelzi, hogy az időintervallum növekedésével magasabb hőmérsékletre van szükség ugyanazon hatás eléréséhez.
Klinikai esetek
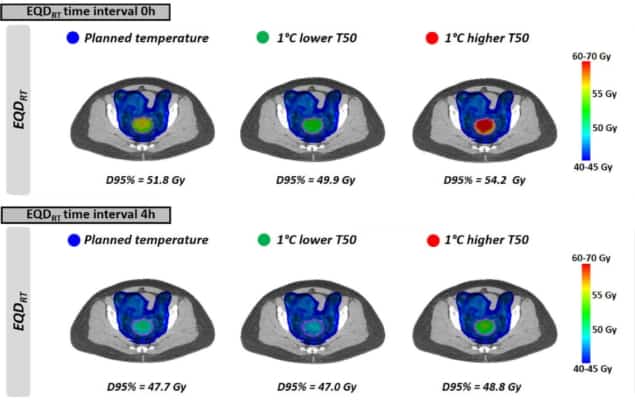
Ezután a kutatók reális kezelési forgatókönyveket értékeltek az inhomogén hőmérséklet-eloszlás és a klinikai sugárterápiás tervek alapján. Kiszámolták az EQD-tRT 10 lokálisan előrehaladott méhnyakrákos beteg számára. Minden beteg 23 × 2 Gy volumetrikus modulált ívterápiában (VMAT) részesült, a kezelés során hetente alkalmaztak hipertermiát.
Amint az az egyenletes hőmérsékleteknél látható, EQDRT legnagyobb volt a legkisebb időintervallumban. Ha a hipertermiát közvetlenül a sugárkezelés előtt vagy után alkalmazták (0 órás időintervallum), az átlagos EQDRT a térfogat 95%-ára (D95%) 51.7 Gy volt, ami 6.3 Gy-es növekedést jelent az önmagában végzett sugárzáshoz képest. Az időintervallum 4 órára növelése ezt az erősítést 2.2 Gy-re csökkentette.
A modell azt jósolta, hogy a dózisnövelés nagy része elveszik az első órán belül. Klinikai alkalmazás esetén ezért a sugárterápia és a hipertermiás szülés közötti időnek a lehető legrövidebbnek kell lennie – ideális esetben, ha mindkét kezelést ugyanabban a kórházban kapják. A kutatócsoport megjegyzi, hogy bár a két kezelés sorrendje klinikailag nem releváns, mivel a daganat felmelegedése időt vesz igénybe, a hipertermia első alkalmazása lényegesen rövidebb időintervallumokat tesz lehetővé, akár 0 óra közelében is.
Végül a kutatók modellezték a tervezettnél valamivel alacsonyabb tumorhőmérséklet elérésének hatását a kezelést korlátozó forró pontok előfordulása miatt. Az EQD hatásaRT A sugárkezelés és a hipertermia közötti rövid időintervallumra volt a legkifejezettebb. 1°C-kal alacsonyabb hőmérséklet és 0 órás időintervallum esetén például az átlagos előrejelzett EQDRT(D95%) 1.8 Gy-vel csökkent (51.7-ről 49.9 Gy-re); 4 órás intervallumban a csökkenés körülbelül 0.7 Gy volt.
A sugárterápia hatásosabb a felmelegedett daganatokban
Azokban az esetekben, amikor nem jelennek meg forró pontok, lehetséges a kimeneti teljesítmény növelése és a tervezettnél magasabb hőmérséklet elérése. Ismét a magasabb hőmérséklet elérésének előnye rövidebb időintervallumok esetén volt a legnagyobb, a pontos nyereség az aktuális hőmérséklettől függött.
„A biológiai modellezés releváns betekintést nyújt a kezelési paraméterek és a várható EQD közötti összefüggésbeRT” – fejezi be Kok és munkatársai. „A magas hőmérséklet és a rövid időintervallumok egyaránt elengedhetetlenek az EQD maximalizálásáhozRT.