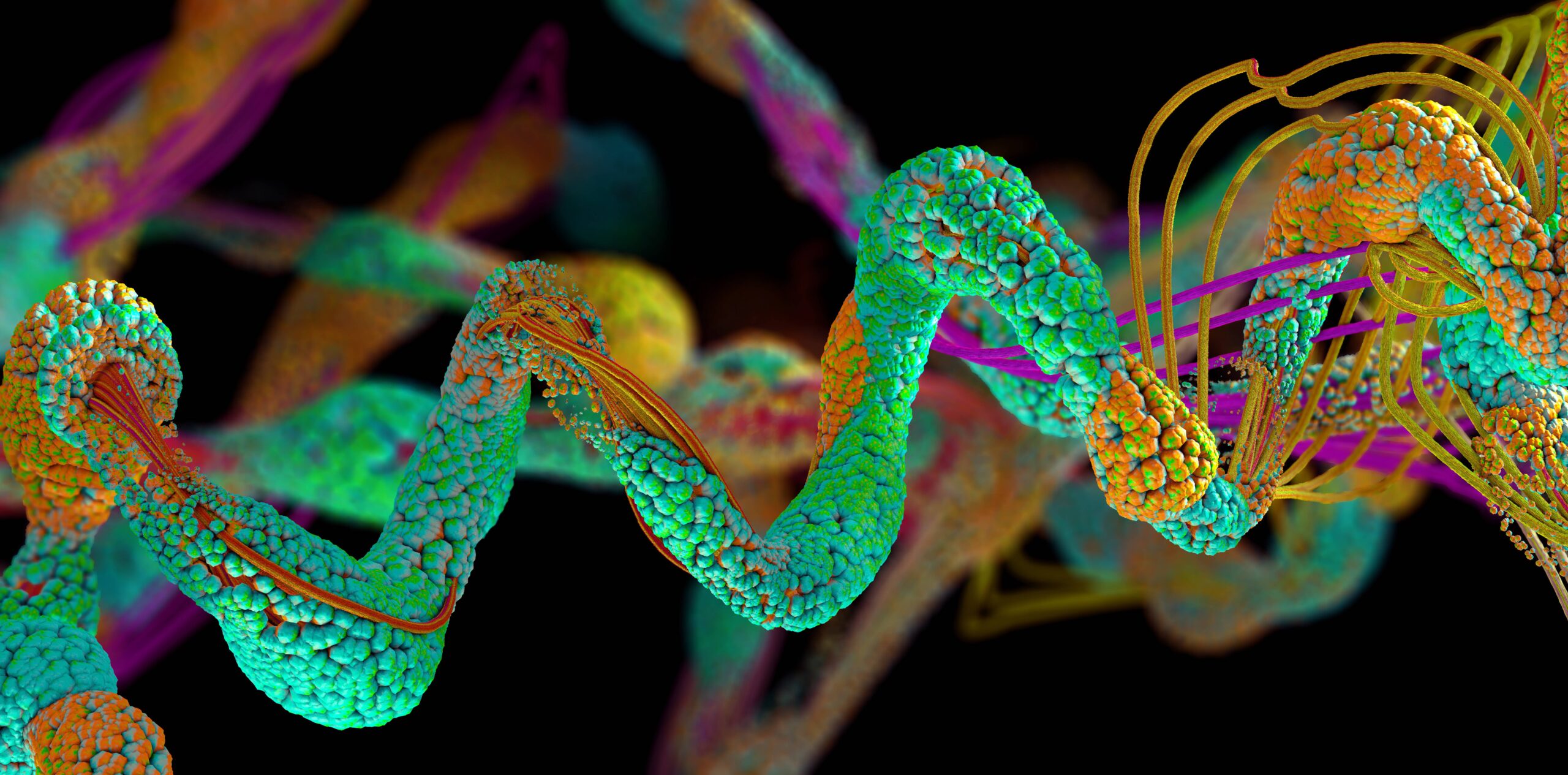
A mesterséges intelligenciával hajtott AlphaFold fehérjehajtogatási modell több mint 200 millió fehérjét jósolt meg, szinte az összes ilyen struktúrát, amelyet a tudomány ismer – közölte csütörtökön a DeepMind.
A fehérjék olyan összetett biológiai molekulák, amelyeket élő szervezetekben a DNS-ben tárolt utasítások alapján állítanak elő. Ezek a 20 féle aminosavból készült nanoméretű láncok létfontosságú sejtfeladatokat látnak el mindenféle testi funkció végrehajtásához. A fehérjék háromdimenziós formájának ismerete azért fontos, mert fizikai felépítése utal arra, hogyan viselkedik, és milyen célt szolgál, ami segít nekünk olyan dolgokban, mint a gyógyszerek kifejlesztése, és másoló fehérjék létrehozása azoknak, akiknek hiányzik ezekből.
Some proteins are helpful, such as those involved in digesting food while others can be harmful, such as those involved in the growth of tumors. Figuring out their complicated wriggly shapes, however, is difficult. Molecular biologists can spend years conducting experiments to decipher a protein’s structure, and AlphaFold can do this in minutes, depending on how large the molecule is, from the amino acid composition.
Az AlphaFoldot több százezer ismert fehérjeszerkezetre oktatták, és megtanulta az alkotó aminosavak és a végső általános formák közötti összefüggéseket. Egy tetszőleges bemeneti aminosav szekvenciával a modell képes megjósolni a 3D fehérje szerkezetét. Mára a modell megjósolta szinte az összes, a tudomány által ismert fehérjeszerkezetet.
Az Európai Bioinformatikai Intézettel együttműködve a DeepMind kibővítette AlphaFold fehérjeszerkezeti adatbázis több mint 200 millió 3D-s fehérjeformát tartalmazni az állatoktól a növényekig, a baktériumoktól a vírusokig – ez több mint 200-szoros növekedés közel egymillió molekuláról legalább 200 millió molekulára mindössze egy év alatt.
“We hoped this groundbreaking resource would help accelerate scientific research and discovery globally, and that other teams could learn from and build on the advances we made with AlphaFold to create further breakthroughs,” Demis Hassibis, DeepMind’s co-founder and CEO, mondott csütörtöki közleményében.
“That hope has become a reality far quicker than we had dared to dream. Just twelve months later, AlphaFold has been accessed by more than half a million researchers and used to accelerate progress on important real-world problems ranging from plastic pollution to antibiotic resistance.”
A regisztráció további megjegyzést kért a DeepMindtől.
Az AlphaFold nagy lehetőségeket mutatott új gyógyszerek tervezésében is. A szerkezetek segítenek a tudósoknak kitalálni azokat a kémiai vegyületeket, amelyek kötődhetnek a célfehérjékhez, hogy kezeljék vagy megakadályozzák, hogy kóros funkciókat hajtsanak végre. A cégek, köztük az Insilco Medicine kísérletezett a modellel új gyógyszerek felfedezésére; Alex Zhavoronkov vezérigazgató elmondta A regisztráció hogy a folyamat sokkal bonyolultabb, mint gondolnád, és több lépésből áll.
It’s not clear how fully accurate AlphaFold’s predictions are. A protein’s ribbon-like structure often changes shape when it interacts with a drug, something AlphaFold cannot help scientists with as it’s not trained on that. Zhavoronkov said the model is a “pretty remarkable breakthrough” but was wary of all the hype.
“Until we see a structure for a novel target in a big disease obtained via AlphaFold without any additional experiments, a molecule designed using AI – or other methods – using this predicted structure, synthesized and tested all the way and then published in a high journal – [we can] then celebrate.”
Big pharma want to see molecules designed with the help of AI tools like AlphaFold actually tested in mice and humans. “Pure algorithmic achievements are not valuable to the pharma companies and especially to the patients,” Zhavoronkov added.
Fabio Urbina, a senior scientist at Collaboration Pharmaceuticals, a startup using machine-learning algorithms to develop drugs for rare genetic diseases, said AlphaFold hasn’t quite yet proved to be useful in his research. Urbina uses a different technique and focuses more on the structure of a potential new drug rather than a target protein.
It has yet to be seen if the protein structures will be useful enough … to help us discover new potential drugs for rare disease
“This is for a few reasons; the protein structures for a lot of drug targets were often not easily available for researchers to use, and protein information did not seem to help the early machine learning models improve their predictive power by a significant margin,” he told A regisztráció.
“I’m cautiously optimistic that AlphaFold has essentially ‘solved’ the first problem, but it has yet to be seen if the protein structures will be useful enough for our downstream application of improving machine-learning predictive power to help us discover new potential drugs for rare diseases. However, we’ve increasingly seen protein structural information taken into account as part of newer machine-learning methods, and we’ve thought about doing the same.”
Making a database with nearly all known protein structures available, as DeepMind has promised, means more scientists will have the resources to experiment and build more powerful AI models, Urbina said. “I’m cautiously optimistic, but with the whole library of protein structures available, I would say there is a good chance that AlphaFold structures will be incorporated into some of our machine-learning models, and may ultimately help us to discover novel therapeutics.” ®
- AI
- ai művészet
- ai art generátor
- van egy robotod
- mesterséges intelligencia
- mesterséges intelligencia tanúsítás
- mesterséges intelligencia a bankszektorban
- mesterséges intelligencia robot
- mesterséges intelligencia robotok
- mesterséges intelligencia szoftver
- blockchain
- blokklánc konferencia ai
- coingenius
- társalgási mesterséges intelligencia
- kriptokonferencia ai
- dall's
- mély tanulás
- google azt
- gépi tanulás
- Plató
- plato ai
- Platón adatintelligencia
- Platón játék
- PlatoData
- platogaming
- skála ai
- szintaxis
- A regisztráció
- zephyrnet