A hasnyálmirigyrák köztudottan halálos betegség, ötéves túlélési aránya körülbelül 9%. Mivel a műtét csak a betegek 8-20%-ának megfelelő, a kemoterápia a leggyakoribb kezelés, a sugárkezelést még mindig ritkán alkalmazzák, és főként adjuváns lehetőségként.
A hasnyálmirigyrák sugárkezelését vizsgáló klinikai vizsgálatok egymásnak ellentmondó eredményeket hoztak, elősegítve a vitát az alkalmazható legjobb irányelvekről és a lehetséges előnyökről. A hasnyálmirigyrák köztudottan rezisztens a kemoterápiával és a sugárterápiával szemben egy rendkívül összetett tumor mikrokörnyezet (TME, a rákos elváltozást körülvevő szövetek) miatt, amelyet változatos sejtpopulációk és erős hipoxiás gradiensek jellemeznek.
Az újabb fejlett sugárterápiás módszerek, mint például az MR-vezérelt sugárterápia, amely MRI-t alkalmaz a sugárdózis irányítására, bizonyos előnyökkel járhat azáltal, hogy pontos információkat szolgáltat a TME-ről. Ezt fel lehet használni a kezelés optimalizálására. A mai napig azonban korlátozottak az ismeretek a sugárzás és az MR-vezérelt sugárterápiás rendszer statikus mágneses tere közötti kölcsönhatásról, és arról, hogy ez hogyan befolyásolhatja a rákos sejtek válaszreakcióit.
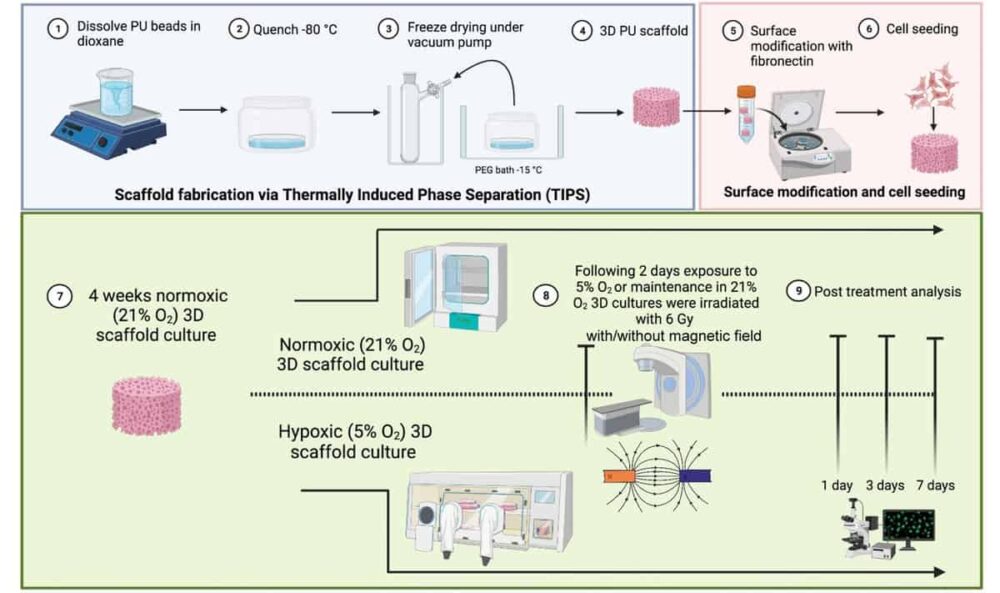
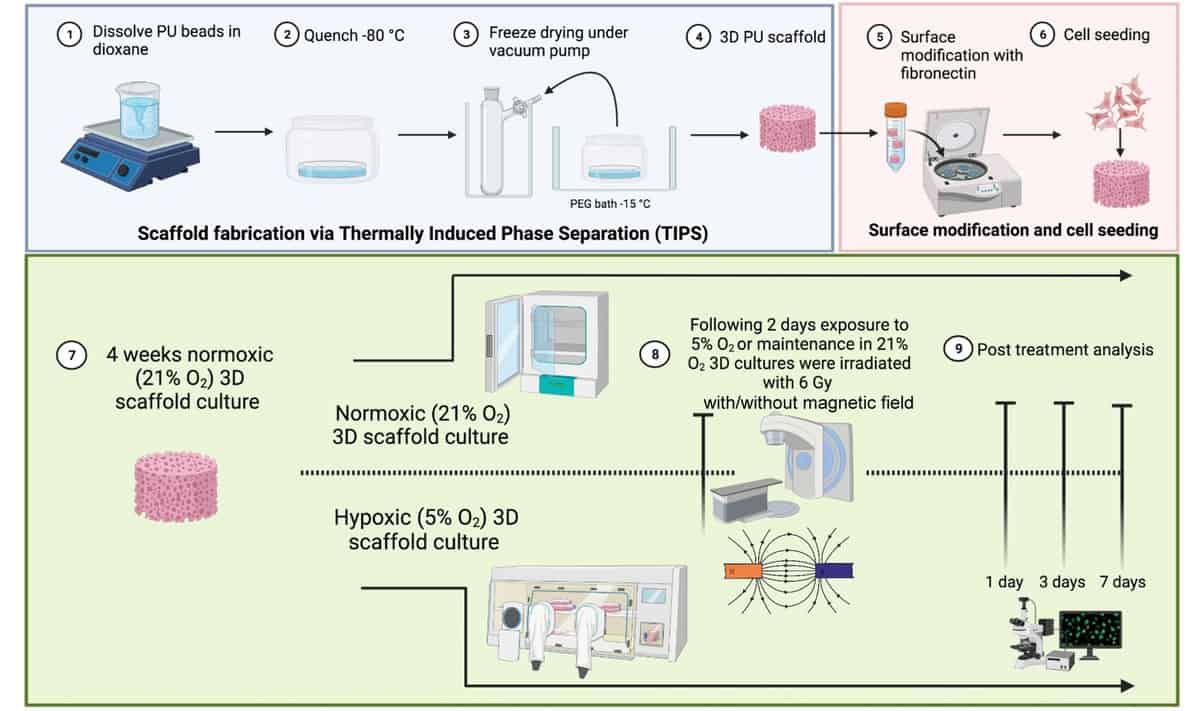
A hasnyálmirigyrákhoz hasonló komplex TME-k tanulmányozásához egy brit kutatócsoport kifejlesztett egy 3D-s polimer, rendkívül makropórusos állványmodellt. A kutatók a Surrey Egyetem, University College London és a Nemzeti Fizikai Laboratórium (NPL), létrehozta a többsejtű, nem állati modellt, hogy értékelje a statikus mágneses mező hatását a hasnyálmirigyráksejtek MR-vezérelt sugárkezelésre adott válaszára.
A hasnyálmirigy duktális adenokarcinómája összetett és erősen immunszuppresszív TME-vel rendelkezik, amely számos különböző sejttípust tartalmaz, beleértve a hasnyálmirigy-csillagsejteket, amelyek a rákos sejtek által aktiválva sűrű desmoplasiát (túlzott kötőszövetet) hoznak létre. Ez a desmoplasia a kaotikus rákos sejtnövekedéssel együtt az erek összeomlását és rendellenes, rendezetlen érhálózatok kialakulását okozza, akadályozva a kemoterápia beadását, és nagy hipoxiás kiterjedéseket hoz létre, amelyek rontják a sugárterápia hatékonyságát.
A 3D-s modell, amelyet a British Journal of Radiology, hasnyálmirigyrák sejteket, humán mikrovaszkuláris endothel sejteket és hasnyálmirigy-csillagsejteket tartalmaz. Egy külső, kollagénnel bevont rekeszből áll a csillag- és endoteliális sejtek növekedéséhez, valamint egy belső, fibronektinnel bevont rekeszből a rákos sejtek növekedéséhez. Ez az architektúra támogatja a különböző TME-sejtek növekedését és proliferációját, lehetővé téve a sejtek számára, hogy egyik kompartmentből a másikba vándoroljanak egy meghosszabbított, 37 napos megfigyelési időszak alatt. Fontos, hogy a modell képes replikálni a TME hipoxiás régióit.
Kutatásvezető Giuseppe Schettino és munkatársai 3D-s állványmodelljükkel vizsgálták a hasnyálmirigyráksejtek sugárzásra adott válaszát statikus mágneses térrel kombinálva. Besugározták a hipoxiának kitett mintákat (1% O2) vagy normoxia (21% O2) 6 MV fotonnal 1.5 T-s mező jelenlétében vagy hiányában, az NPL-nél erre a célra szolgáló berendezéssel. Ezután egy és hét nappal a besugárzás után figyelték a sejtek életképességét és a sejt apoptózisát.
Az eredmények szisztematikus tendenciát mutattak ki a hipoxiával összefüggő sugárvédelemre a hasnyálmirigyrák sejtjeiben a 3D-s állványzatban, megnövekedett tumorsejtek életképességével és csökkent sejtapoptózissal, amely mind a rövid, mind a hosszú távú elemzésekben látható. Pontosabban, az állványok besugárzása normoxiában az élő sejtek számának szignifikáns csökkenéséhez vezetett, míg a hipoxiában sugárzással kezeltek nem mutattak szignifikáns csökkenést. A csapat megjegyzi, hogy ez összhangban van a sugárvédelemre vonatkozó korábbi megállapításokkal in vitro hypoxia.
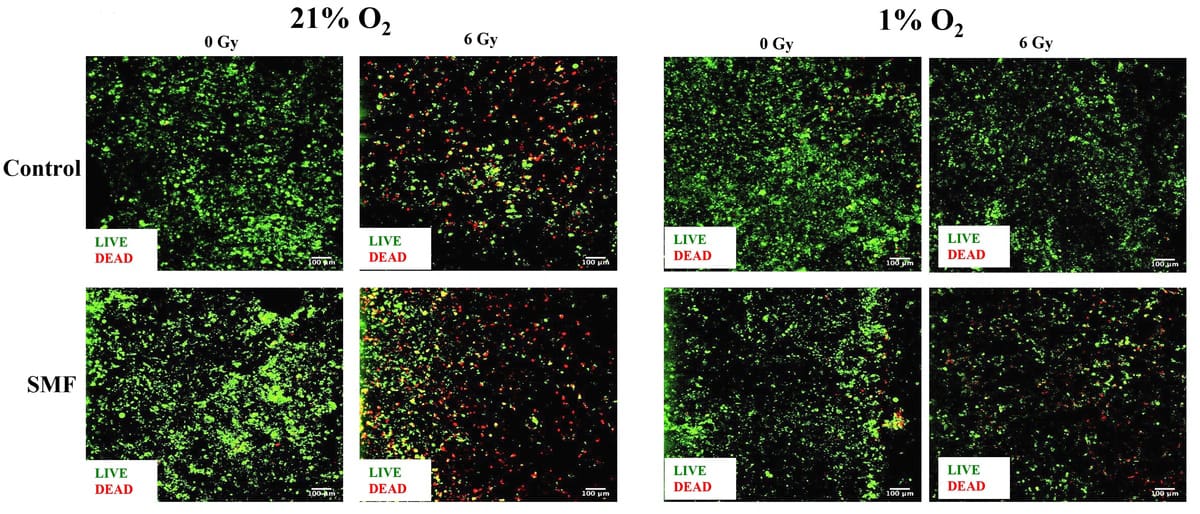
A kutatók arról számoltak be, hogy mind hipoxia, mind normoxia esetén a sugárzás hatásának kismértékű fokozódását figyelték meg statikus mágneses tér jelenlétében. A mágneses térnek való kitettség önmagában nem okozott toxicitást. Most azt tervezik, hogy megvizsgálják azokat a mechanizmusokat, amelyek felelősek az ilyen sugárzás fokozásáért a jövőbeli tanulmányok során.
„Fontos, hogy jó modellek álljanak rendelkezésre a nehezen kezelhető rákos megbetegedések új terápiás megközelítéseinek tesztelésére, mint például a képvezérelt sugárterápia, amely erős mágneses tereket alkalmaz” – mondja Schettino. „Mielőtt új megközelítéseket alkalmaznánk klinikailag, azokat jól ki kell értékelni és meg kell érteni a preklinikai szinten, ami általában olyan állatmodellek használatát igényli, amelyek nem mindig reprezentálják megfelelően az embert. Nem állati modellünk képes felmérni a mágneses tér sugárzási reakcióra gyakorolt lehetséges hatását.
Az ionizáló sugárzás lágyítja a daganat mikrokörnyezetét
„Munkánk célja a rák sugárkezelésének javítása biológiailag optimalizáltabb megközelítésen keresztül” – mondja Fizika világ. „Elemeznünk kell, hogy a mágneses tér, a sugárnyaláb, valamint a sejtes és molekuláris folyamatok közötti kölcsönhatás hogyan változtathatja meg a normál és a rákos szövetek válaszreakcióit, és ezáltal a sugárterápia hatékonyságát. Az ilyen hatás vagy a hatás hiányának becslése hasznos az új klinikai vizsgálatok tervezésében és tervezésében.”
Schettino azt tanácsolja, hogy az NPL érdeklődik a többsejtű állványmodell protonsugarakkal és potenciálisan FLASH nyalábokkal történő alkalmazása iránt.
- SEO által támogatott tartalom és PR terjesztés. Erősödjön még ma.
- Platoblockchain. Web3 metaverzum intelligencia. Felerősített tudás. Hozzáférés itt.
- Forrás: https://physicsworld.com/a/3d-cancer-model-reveals-how-a-static-magnetic-field-can-enhance-radiotherapy/
- :is
- 1
- 10
- 3d
- 7
- a
- Képes
- Rólunk
- AC
- pontos
- Elfogadása
- fejlett
- Után
- kizárólag
- mindig
- elemzés
- elemzések
- és a
- állat
- Másik
- alkalmaz
- megközelítés
- megközelít
- megfelelő
- építészet
- AS
- társult
- At
- BE
- Gerenda
- haszon
- Előnyök
- BEST
- között
- vér
- by
- TUD
- Rák
- Ráksejtek
- okai
- Cellák
- jellemzett
- kettyenés
- Klinikai
- klinikai vizsgálatok
- CO
- Összeomlás
- munkatársai
- Főiskola
- kombináció
- Közös
- bonyolult
- Ellentmondó
- tudott
- teremt
- készítette
- létrehozása
- találka
- nap
- Nap
- vita
- csökkenés
- elszánt
- kézbesítés
- leírt
- tervezés
- fejlett
- DID
- különböző
- betegség
- számos
- ne
- alatt
- hatás
- hatékonyság
- alkalmaz
- lehetővé téve
- felszerelés
- értékelni
- értékelték
- vizsgálva
- kitett
- Exponálás
- rendkívüli módon
- mező
- Fields
- Vaku
- A
- képződés
- ból ből
- jövő
- jó
- színátmenetek
- Zöld
- Növekedés
- útmutató
- irányelvek
- Legyen
- hasznos
- nagyon
- Hogyan
- azonban
- HTTPS
- emberi
- Az emberek
- kép
- Hatás
- fontos
- javuló
- in
- Beleértve
- <p></p>
- információ
- kölcsönhatás
- érdekelt
- vizsgálja
- kérdés
- IT
- folyóirat
- jpg
- tudás
- laboratórium
- hiány
- nagy
- Led
- szint
- mint
- Korlátozott
- vonal
- él
- hosszú lejáratú
- Mágneses mező
- sok
- max-width
- vándorol
- modell
- modellek
- molekuláris
- ellenőrizni
- több
- a legtöbb
- MRI
- nemzeti
- Szükség
- hálózatok
- Új
- normális
- Megjegyzések
- of
- on
- ONE
- nyitva
- Optimalizálja
- optimalizált
- opció
- betegek
- időszak
- Fotonok
- fizikai
- terv
- tervezés
- emelvény
- Plató
- Platón adatintelligencia
- PlatoData
- populációk
- potenciális
- potenciálisan
- jelenlét
- előző
- Folyamatok
- Készült
- támogatása
- ad
- Sugárkezelés
- Arány
- Piros
- tekintettel
- régiók
- jelentést
- képvisel
- megköveteli,
- kutatás
- kutatók
- ellenálló
- válasz
- felelős
- Eredmények
- Revealed
- felfedi
- azt mondja,
- hét
- rövid időszak
- jelentős
- kicsi
- néhány
- kifejezetten
- Még mindig
- erős
- tanulmányok
- Tanulmány
- Tanul
- ilyen
- ellátó
- Támogatja
- Sebészet
- környező
- túlélés
- rendszer
- csapat
- megmondja
- teszt
- hogy
- A
- azok
- ebből adódóan
- Keresztül
- miniatűr
- nak nek
- kezelés
- tendencia
- vizsgálatok
- igaz
- típusok
- Uk
- alatt
- megértett
- használ
- rendszerint
- Hajó
- életképesség
- JÓL
- ami
- míg
- val vel
- nélkül
- Munka
- világ
- zephyrnet