Introduzione
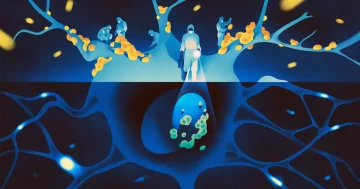
Una madre dà tutto al suo bambino: amore, abbracci, baci... e un robusto esercito di batteri.
Queste semplici cellule, che viaggiano dalla madre al bambino alla nascita e nei mesi di contatto intimo che seguono, formano i primi semi del microbioma del bambino, la comunità in evoluzione di microrganismi simbiotici legati al sano funzionamento del corpo. I ricercatori del Broad Institute del Massachusetts Institute of Technology e dell'Università di Harvard hanno recentemente condotto la prima indagine su larga scala su come i microbiomi di una madre e del suo bambino coevolvono durante il primo anno di vita. Il loro nuovo studio, pubblicato in Cella in dicembre ha scoperto che questi contributi materni non sono limitati alle cellule complete. Piccoli frammenti di DNA chiamati elementi genetici mobili saltano dai batteri della madre ai batteri del bambino, anche mesi dopo la nascita.
Questa modalità di trasferimento, mai vista prima nella coltivazione del microbioma di un neonato, potrebbe svolgere un ruolo cruciale nel promuovere la crescita e lo sviluppo. Capire come si evolve il microbioma di un bambino potrebbe spiegare perché alcuni bambini sono predisposti a certe malattie più di altri, ha affermato Vittoria Carr, uno dei principali bioinformatici del Wellcome Sanger Institute che non faceva parte dello studio.
"È una grande domanda: come otteniamo i nostri microbi?" disse Nicola Segata, un professore dell'Università di Trento in Italia che non faceva parte dello studio.
I nostri corpi ospitano circa tante cellule batteriche quante cellule umane, e la maggior parte di esse vive all'interno delle nostre viscere. Ognuno di noi ospita librerie enormemente diverse di specie batteriche e ceppi acquisiti nel corso della vita. Ma i bambini iniziano quasi sterili. Si pensa che la prima grande infusione di microbi provenga dalla madre durante il parto quando il bambino esce dall'utero. Quel dono batterico crea l'impalcatura per una fiorente comunità microbica nel corpo che ci sostiene per il resto della nostra vita. (I neonati nati con taglio cesareo non ricevono la stessa infusione iniziale di microbi che i bambini ricevono dalla nascita vaginale, ma li raccolgono lentamente in seguito.)
Uno degli effetti del microbioma, ha spiegato Segata, è quello di condizionare il sistema immunitario e il metabolismo del suo ospite durante i primi due anni di vita. Questi primi giorni di formazione “possono avere conseguenze di lunga durata che in questo momento sono ancora difficili da comprendere”, ha affermato.
Questo perché si ritiene che i metaboliti, o prodotti chimici del metabolismo, prodotti dal microbioma influenzino lo sviluppo cognitivo e del sistema immunitario di un bambino, in particolare durante un periodo sensibile nei 1,000 giorni prima e dopo la nascita, ha detto Karolina Jabbar, internista e ricercatore presso l'Università di Göteborg, co-autore principale del nuovo documento.
Nel nuovo studio, guidato da Ramnik Saverio, direttore del Klarman Cell Observatory presso il Broad Institute, i ricercatori hanno raccolto campioni di feci da 70 coppie di madri e dei loro bambini, iniziando all'inizio della gravidanza e continuando per il primo anno del bambino. I ricercatori hanno quindi esaminato il mix di microbi e composti presenti nei campioni e hanno eseguito analisi genetiche per determinare quali specie e quali ceppi di microbi erano presenti. Con questi dati, hanno potuto vedere come i microbiomi delle madri e dei bambini si sono coevoluti durante quel periodo.
Come si aspettavano, i microbiomi dei neonati erano diversi da quelli delle loro madri e l'influenza della dieta sui loro microbiomi era chiara. I bambini avevano centinaia di metaboliti che le loro madri non avevano.
La grande sorpresa per il team è stata che anche quando a un bambino mancavano ceppi batterici utili presenti nella madre, il microbioma del bambino aveva ancora frammenti di geni appartenenti a quei ceppi.
"Come potrebbe la specie influenzare la composizione microbica infantile senza nemmeno farne parte?" Jabbar ha detto. Lei e i suoi compagni di laboratorio hanno iniziato a chiedersi se questo potesse essere spiegato dal trasferimento genico orizzontale, un processo bizzarro in cui i geni di una specie saltano su un'altra specie invece di essere trasmessi a una prole. I trasferimenti genici orizzontali sono comuni all'interno delle comunità di batteri - contribuiscono notevolmente alla diffusione di geni resistenti agli antibiotici in una varietà di agenti patogeni, ad esempio - e si è anche scoperto che si verificano negli organismi pluricellulari.
Tuttavia, i ricercatori non erano preparati a vedere centinaia di geni saltare tra le comunità batteriche, dal microbioma della madre a quello del bambino. "È una di quelle cose che all'inizio non credi a te stesso", ha detto Tommi Vatanen, ricercatore presso l'Università di Helsinki e co-autore principale del documento.
I ricercatori ipotizzano che i trasferimenti genici orizzontali possano essere più evidenti quando i batteri che prosperano nell'intestino della madre non possono sopravvivere nell'ambiente sconosciuto dell'intestino del bambino. I batteri materni possono entrare nel corpo del bambino attraverso il latte materno o come spore rilasciate che il bambino ingerisce. Alcuni batteri inevitabilmente non riusciranno a colonizzare il corpo del bambino e scompariranno. Ma potrebbero durare abbastanza a lungo da consentire a determinate sequenze geniche di entrare in batteri più efficaci. Se quelle sequenze genetiche mettono radici nei genomi dei batteri all'interno dell'intestino del bambino, possono trasferire le funzioni che codificano.
"Il fatto che anche un'esistenza transitoria di una cellula donatrice possa avere un tale impatto su quelle persistenti è davvero affascinante", ha detto Carr.
Introduzione
In alcuni casi, questi luppoli potrebbero essere stati resi possibili dai profagi, virus dormienti che si replicano nei batteri. Nell'ambiente stressante dell'intestino del bambino, i profagi possono diventare attivi e iniziare a muoversi tra i batteri, portando con sé geni batterici incorporati.
Nella loro analisi dei campioni di feci infantili, Vatanen, Jabbar e i loro colleghi hanno identificato un esempio evidente: un profago integrato nel DNA di una specie batterica è apparso mesi dopo in un batterio diverso.
"È una prova abbastanza convincente che questo particolare fago sia passato da una specie all'altra", ha detto Vatanen. I ricercatori hanno anche scoperto che i geni saltavano tra le specie batteriche in altri modi, ad esempio attraverso il contatto diretto da cellula a cellula o attraverso una cellula batterica che inghiotte il DNA rilasciato nell'ambiente.
Un grande gruppo di geni che saltava codificava il meccanismo cellulare che rende possibili i trasferimenti genici orizzontali. Altre sequenze mobili hanno contribuito al metabolismo dei carboidrati e degli aminoacidi e potrebbero quindi aver apportato grandi benefici ai batteri. Ad esempio, i risultati suggeriscono che i geni legati alla digestione dei carboidrati trovati nel latte materno potrebbero essere condivisi dalle madri ai bambini in questo modo, ha detto Jabbar. I ricercatori non sanno per certo che i trasferimenti orizzontali avvantaggino direttamente il bambino, ma assemblando un microbioma intestinale più capace, possono aiutare con lo sviluppo del sistema immunitario del bambino.
Alcune di queste sequenze genetiche sono comparse in nuovi batteri mesi dopo la nascita, il che suggerisce che i trasferimenti hanno continuato a verificarsi durante quel periodo. Non è chiaro se i trasferimenti avvenissero anche prima della nascita, ma i ricercatori hanno scoperto che il microbioma della madre si è evoluto durante la gravidanza. Alcuni dei cambiamenti sembravano in grado di influenzare la capacità del corpo di tollerare il glucosio. Questi risultati suggeriscono che il diabete che alcune persone sviluppano durante la gravidanza potrebbe essere collegato al microbioma.
Quando i ricercatori hanno raccolto campioni di feci dai neonati, hanno anche prelevato campioni delle loro cellule immunitarie. Ora stanno progettando di utilizzare quei campioni per esaminare come i batteri che portano i bambini, compresi quelli che contengono questi elementi mobili, interagiscono con le cellule immunitarie. Le intuizioni di questi esperimenti potrebbero portare a una migliore comprensione di come e perché alcune persone sviluppano allergie o malattie autoimmuni.
L'esistenza di tali elementi mobili è nota da quando la pionieristica genetista Barbara McClintock li scoprì negli anni '1940, un risultato per il quale vinse il Premio Nobel. "Ma non è mai stato caratterizzato in modo così approfondito fino a poco tempo fa", ha detto Carr. "Ora che stiamo ottenendo maggiori informazioni, ci stiamo rendendo conto che in realtà gli elementi genetici mobili stanno avendo un impatto maggiore di quanto pensassimo in precedenza".
In noi, si scopre, quell'impatto inizia molto presto nella vita.
- Distribuzione di contenuti basati su SEO e PR. Ricevi amplificazione oggi.
- Platoblockchain. Web3 Metaverse Intelligence. Conoscenza amplificata. Accedi qui.
- Fonte: https://www.quantamagazine.org/mobile-genes-from-the-mother-shape-the-babys-microbiome-20230117/
- 000
- 1
- 11
- 2022
- 70
- a
- capacità
- Chi siamo
- AC
- realizzazione
- acquisito
- attivo
- effettivamente
- influenzare
- Dopo shavasana, sedersi in silenzio; saluti;
- Tutti
- Allergie
- Analisi
- .
- ed
- Un altro
- apparente
- Army
- autore
- Neonato
- batteri
- perché
- diventare
- prima
- essendo
- CREDIAMO
- beneficio
- Meglio
- fra
- Big
- maggiore
- stile di vita
- Dezen Dezen
- portare
- ampio
- detto
- capace
- trasportare
- trasporto
- casi
- Celle
- certo
- Modifiche
- caratterizzato
- chimico
- Bambini
- pulire campo
- conoscitivo
- colleghi
- Venire
- Uncommon
- Comunità
- comunità
- completamento di una
- comprendere
- condizione
- Conseguenze
- contatti
- continua
- continua
- contribuire
- contributi
- potuto
- Coppia
- crea
- cruciale
- dati
- Giorni
- Dicembre
- profondità
- Determinare
- sviluppare
- Mercato
- Diabete
- DID
- Dieta
- diverso
- difficile
- dirette
- direttamente
- Direttore
- scomparire
- scoperto
- malattie
- paesaggio differenziato
- dna
- Dont
- giù
- durante
- ogni
- Presto
- effetti
- elementi
- incorporato
- abbastanza
- entrare
- Ambiente
- Anche
- prova
- si è evoluta
- evoluzione
- esempio
- uscite
- previsto
- Spiegare
- ha spiegato
- FAIL
- affascinante
- compagno
- Trovare
- Nome
- seguire
- modulo
- essere trovato
- da
- funzionamento
- funzioni
- ottenere
- ottenere
- regalo
- dà
- molto
- Gruppo
- Crescita
- harvard
- Università di Harvard
- avendo
- sano
- Aiuto
- aiutato
- Casa
- Orizzontale
- Come
- HTML
- HTTPS
- umano
- centinaia
- identificato
- Sistema immunitario
- Impact
- in
- In altre
- Compreso
- inevitabilmente
- influenza
- infusione
- inizialmente
- intuizioni
- invece
- Istituto
- integrato
- interagire
- intimo
- IT
- Italia
- viaggio
- saltato
- Sapere
- conosciuto
- laboratorio
- larga scala
- Cognome
- portare
- Guidato
- biblioteche
- Vita
- probabile
- Limitato
- connesso
- vivere
- Lives
- Lunghi
- amore
- macchinario
- fatto
- maggiore
- FA
- modo
- molti
- Massachusetts
- Istituto di Tecnologia del Massachussetts
- massicciamente
- Metabolismo
- forza
- latte
- Mobile
- mese
- Scopri di più
- maggior parte
- madre
- in movimento
- New
- premio Nobel
- osservatorio
- ovvio
- ONE
- Altro
- Altri
- coppie
- Carta
- parte
- particolare
- particolarmente
- Passato
- Persone
- periodo
- pionieristico
- pianificazione
- Platone
- Platone Data Intelligence
- PlatoneDati
- Giocare
- possibile
- Gravidanza
- preparato
- presenti
- in precedenza
- Direttore
- premio
- processi
- Prodotti
- Insegnante
- promuovere
- pubblicato
- Quantamagazine
- domanda
- realizzato
- realizzando
- recentemente
- relazionato
- rilasciato
- riparazioni
- ricercatore
- ricercatori
- REST
- Risultati
- Ruolo
- radice
- Suddetto
- stesso
- Sezione
- semi
- sembrava
- delicata
- Forma
- condiviso
- Un'espansione
- da
- Lentamente
- piccole
- alcuni
- diffondere
- inizia a
- iniziato
- Di partenza
- inizio
- Ancora
- Tensioni
- Studio
- di successo
- tale
- suggerisce
- sorpresa
- Indagine
- intervistati
- sopravvivere
- Simbiotico
- sistema
- Fai
- team
- Tecnologia
- I
- loro
- perciò
- cose
- pensiero
- Prosperare
- fiorente
- Attraverso
- per tutto
- Legato
- tempo
- a
- Training
- trasferimento
- trasferimenti
- Turned
- e una comprensione reciproca
- sconosciuto
- Università
- us
- uso
- varietà
- virus
- modi
- WebP
- se
- quale
- while
- OMS
- volere
- entro
- senza
- Ha vinto
- anno
- anni
- Tu
- te stesso
- zefiro