מדעני מוח, המתעניינים כיצד פועל המוח, מתמקדים באופן טבעי בנוירונים, התאים שיכולים להעביר אלמנטים של חוש ומחשבה זה לזה באמצעות דחפים חשמליים. אבל ראוי למחקר באותה מידה הוא חומר שנמצא ביניהם - ציפוי צמיג בצד החיצוני של הנוירונים האלה. בערך שווה ערך לסחוס באף ובמפרקים שלנו, החומר נצמד כמו רשת דייגים לכמה מהנוירונים שלנו, מה שמעורר את השם רשתות perineuronal (PNNs). הם מורכבים משרשראות ארוכות של מולקולות סוכר המחוברות לפיגום חלבון, והם מחזיקים נוירונים במקום, ומונעים מהם לנבוט וליצור קשרים חדשים.
בהינתן יכולת זו, הציפוי העצבי המעט מוכר הזה מספק תשובות לכמה מהשאלות התמוהות ביותר על המוח: מדוע מוחות צעירים סופגים מידע חדש כל כך בקלות? מדוע כל כך קשה לשכוח את הזיכרונות המפחידים הנלווים להפרעת דחק פוסט טראומטית (PTSD)? למה כל כך קשה להפסיק לשתות אחרי שהתלות באלכוהול? ולפי מחקר חדש מדען המוח ארקדי חוטורסקי ועמיתיו באוניברסיטת מקגיל, אנו יודעים כעת ש-PNN גם מסביר מדוע כאב יכול להתפתח ולהימשך כל כך הרבה זמן לאחר פציעה עצבית.
פלסטיות עצבית היא היכולת של רשתות עצביות להשתנות בתגובה לחוויות בחיים או לתקן את עצמן לאחר פגיעה מוחית. הזדמנויות כאלה לשינוי ללא מאמץ ידועות כתקופות קריטיות שבהן הן מתרחשות בשלב מוקדם בחיים. חשבו באיזו קלות תינוקות קולטים שפה, אבל כמה קשה ללמוד שפה זרה כמבוגר. במובן מסוים, זה מה שהיינו רוצים: לאחר שנוצרות הרשתות הנוירונים המורכבות שמאפשרות לנו להבין את שפת האם שלנו, חשוב שהן יהיו נעולות, כך שהרשתות נשארות יחסית לא מופרעות למשך שארית חיינו.
המשמעות היא שאחרי תקופה קריטית, רשתות עצביות הופכות עמידות בפני שינויים, ו-PNNs הם הסיבה העיקרית לכך. הם נוצרים מעל נוירונים ונועלים את חיווט הרשת העצבית במקומם בסוף התקופה הקריטית. זה קורה לרוב בין הגילאים 2 עד 8, אבל PNN נוצרים גם על נוירונים בבגרות בקשר להתנהגויות שקשה לשבור, או ביצירת זיכרונות ארוכי טווח. אם נוכל לדחות את סגירתן של תקופות קריטיות, או איכשהו לפתוח אותן מחדש מאוחר יותר בחיים, הדבר היה מחזיר את הפלסטיות העצבית הצעירה, מקדם החלמה מפציעה ומבטל הפרעות נוירולוגיות קשות העמידות בפני שינויים.
מחקרים עדכניים מראים שאכן ניתן לעשות זאת, פשוט על ידי מניפולציה של PNNs. לדוגמה, החזקת בעל חיים בחושך מוחלט מאטה את התפתחותם של PNNs על נוירוני הראייה, ושומרת על התקופה הקריטית עבור פלסטיות עצבית כדי לתקן בעיות ראייה הרבה יותר זמן. סוכנים כימיים ומניפולציה גנטית יכולים גם לפגום PNNs ולפתוח מחדש תקופות קריטיות, וחוקרים עשו זאת כדי לגרום לעכברים לשכוח זיכרונות שגרמו להם PTSD (במקרה שלהם, זיכרונות של הלם חשמלי שניתנה מיד לאחר ששמעו צליל).
זה גם אפשרי לעורר את הצמיחה של PNNs. זה קורה כאשר מישהו שותה אלכוהול בכמות מוגזמת, מה שגורם להיווצרות רשתות אלו על נוירונים המעורבים בהתמכרות. מאמינים שהציפוי מגן על נוירונים מהרעילות הכימית של האלכוהול, אך הוא גם נועל את תהליך החשיבה שמעורר דחף משתלט לשתות.
בעוד שמדעי המוח למדו על היבטים אלה של PNNs בעשורים האחרונים, השפעת PNNs על כאב כרוני הייתה גילוי בלתי צפוי לאחרונה. עבודה זו, שמרחיבה עוד יותר את השפעת הרשתות מעבר לתקופות קריטיות, לא רק משפרת את הבנתנו את המדע הבסיסי של הכאב, אלא גם נותנת לנו תמונה טובה יותר של ה-PNN עצמם.
כאב כרוני, הנמשך זמן רב לאחר פציעה, משקף שינוי במעגלים הנוירונים שעלולים להיות קשה להתגבר עליו. כשמשהו כואב, כל הגוף שלנו מתערב. נוירוני כאב מיוחדים בכל הגוף מעבירים דחפים עצביים לתוך חוט השדרה, שם הם מועברים למוח. משמעות הדבר היא כי חוט השדרה ממלא תפקיד מרכזי בתחושת הכאב שלנו; ואכן, לעתים קרובות רופאים מנהלים את כאב הלידה על ידי מתן אפידורל, הכולל הזרקת חומרי הרדמה לחלל המקיף את חוט השדרה המותני, וחוסם דחפים עצביים מלהגיע למוח.
עכשיו תארו לעצמכם אם במקום לדכא שידור עצבי בשלב זה, פגיעה עצבית גרמה לאותם נוירונים לרגישים יתר. אפילו מגע עדין באזור הפגוע יגרום למטח של דחפים נוירונים לנוע במעלה חוט השדרה, ונרשם ככאב עז. מחקרים קודמים זיהו כמה מנגנונים שיכולים לגרום לרגישות יתר כזו, אבל אף אחד לא ציפה ש-PNN יהיו מעורבים.
אולם, לפני מספר שנים, חוטורסקי ראה מאמר שדיווח ש-PNN מצפים נוירונים קטנים מסוימים באזור מוח שבו מועבר מידע על כאב. "אינטרנוירונים מעכבים" אלו יוצרים סינפסות על נוירוני הכאב, המדכאים את יכולתם להעביר אותות כאב. חוטורסקי תהה אם ייתכן שאנשי PNN עושים משהו דומה בנקודת ממסר הכאב הקריטית בתוך חוט השדרה, והוא ביקש מתלמידתו שאנון טנסלי לתואר שני לבדוק את זה. "באותה תקופה שום דבר לא היה ידוע", אמר חוטורסקי.
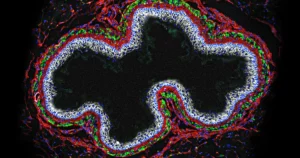
טנסלי אכן גילה ש-PNNs עוטפים נוירונים מסוימים בחוט השדרה, שם הוא מעביר אותות כאב למוח. לנוירונים יש אקסונים ארוכים ("הזנב" ששולח אותות לתא הבא בתור) המפנים את חוט השדרה אל המוח. יש להם גם קבוצה של אינטרנוירונים מעכבים המחוברים אליהם דרך חורים קטנים ב-PNN, והנוירונים המעכבים יכולים לדכא את הירי של הנוירונים הבולטים הארוכים, לכווץ את האות המגיע למוח ולהקהות את תחושת הכאב. טנסלי גילתה, להפתעתה, שרק הנוירונים המעכבים הללו בנקודת הממסר של חוט השדרה היו מצופים PNNs.
ממצא זה נתן השראה לצוות של חוטורסקי לבצע ניסויים בעכברי מעבדה כדי לקבוע אם הרשתות הללו היו מעורבות איכשהו בכאב כרוני לאחר פגיעה בעצב היקפי. הם חתכו ענפים של עצב הרגל האחורית של עכבר, הידוע כ-sciatic, בזמן שהוא היה בהרדמה כללית. זה מחקה פציעות סיאטיות באנשים, אשר ידועות כגורמות לכאב מתמשך. ימים לאחר מכן, הצוות של חוטורסקי מדד את סף הכאב של העכבר עם בדיקות לא מזיקות, כמו תזמון כמה מהר הוא נרתע ממשטח מחומם. כצפוי, הצוות ראה את תצוגת העכבר מגבירה בחדות את רגישות הכאב - אך הם גם הבחינו ש-PNNs סביב הנוירונים המקרינים התמוססו. בדיוק כפי ששינויי המוח בתקופות קריטיות משפיעות על PNN, השינויים הפתאומיים לאחר פגיעה עצבית בעכבר שינו את ה-PNN במעגל הכאב של חוט השדרה שלו.
לאחר מכן, הצוות הבין מה גורם להרס של הרשתות: מיקרוגליה, תאי המוח וחוט השדרה שמתחילים תיקונים לאחר מחלה ופציעה. כדי לבדוק את הקשר בין מיקרוגליה לכאב, הצוות פנה לעכברים ללא מיקרוגליה כמעט (התאפשרה באמצעות הנדסה גנטית) וביצע את אותה פעולה. בעכברים אלה, ה-PNNs נותרו שלמים לאחר ניתוח העצב הסיאטי, ולמרבה הפלא, העכברים לא הפכו לרגישים יתר לגירויים כואבים. כדי לאשר את הקשר, הצוות השתמש באמצעים שונים כדי להמיס את הרשתות, מה שהעלה את רגישות העכברים לכאב.
זה הוכיח ש-PNNs דיכאו ישירות רגישות לכאב. על ידי מדידת שידור סינפטי עם אלקטרודות, הצוות של חוטורסקי אפילו גילה איך זה עובד. השפלה של ה-PNNs גרמה לתגובת שרשרת שהביאה לאיתות מוגבר מהנוירונים המקרינים ששולחים אותות כאב למוח: כאשר המיקרוגליה המגיבה לפציעה העצבית המיסה את ה-PNN, הדבר החליש את ההשפעה של הנוירונים המעכבים שבדרך כלל מבליטים את הירי של הנוירונים של הקרנת המוח. איבוד הבלמים המעכבים שלהם פירושו ירי עצבי בורח וכאב עז.
מיקרוגליה משחררת חומרים רבים הגורמים לנוירוני כאב להפוך לרגישים יתר לאחר פגיעה עצבית, אך לפעולה הבלתי צפויה שלהם על PNNs יש יתרון מרכזי: ספציפיות. "בדרך כלל מה שרשתות פרינורונאליות עושות הוא שהן נועלות את הפלסטיות, והן גם מגנות על תאים", אמר חוטורסקי. "אז למה הרשתות האלה נמצאות רק סביב נוירוני ממסר הכאב האלה, ולא סביב סוגי תאים אחרים [סמוכים]?" הוא חושד שזה בגלל שנקודת ממסר הכאב הזו בחוט השדרה כל כך חשובה שהנוירונים האלה והחיבורים שלהם צריכים הגנה נוספת כדי שהשליטה שלהם בהעברת הכאב תהיה חזקה ואמינה. רק משהו דרמטי כמו פגיעה עצבית יכול לשבש את היציבות הזו.
"היופי במנגנון זה הוא שהוא סלקטיבי עבור סוגי תאים ספציפיים", אמר חוטורסקי. החומרים המיקרוגליים משחררים כדי להגביר את הירי העצבי וגורמים לכאב לאחר פגיעה עצבית משפיעים על כל סוגי התאים בסביבה, אך ה-PNNs עוטפים רק את הנוירונים הללו בדיוק בנקודת הממסר הקריטית בחוט השדרה.
מחקר מתנהל כדי להבין טוב יותר את המנגנון החדש הזה של כאב כרוני. אם חוקרים יוכלו לפתח שיטות לבנות מחדש PNNs על נוירונים אלה לאחר פציעה, זה יכול לספק טיפול חדש לכאב כרוני - צורך דחוף, בהתחשב בכך שאופיאטים, הפתרון הנוכחי, מאבדים את עוצמתם לאורך זמן ועלולים להפוך לממכרים או לגרום למחלה קטלנית. מנת יתר.
מה שמתרחש בתוך נוירונים מרתק וחשוב להבנה, אבל רשתות עצביות נוצרות על ידי נוירונים בודדים המקושרים זה לזה, וכאן המלט הסחוסי המוזנח בחלל ביניהם הוא חיוני.