טיפול בחלקיקים - טיפול בסרטן באמצעות קרני פרוטונים או יונים כבדים יותר - מספק מתן מינון קונפורמי ביותר וחיסכון גדול יותר ברקמות נורמליות בהשוואה לקרינה רגילה מבוססת פוטון. אבל עבור שורדי סרטן לטווח ארוך, הסיכון לסרטן שניוני המושרה מקרינה (SC) חשוב, ויש לקחת בחשבון בעת בחירת אופן הטיפול שלהם.
עם נתונים אפידמיולוגיים דלים עבור טיפולים חדשים יותר כגון טיפול פרוטונים ופחמן-יון, צוות עמד בראש מרכז GSI הלמהולץ לחקר יונים כבדים מפתחת מודל להשוואת סיכוני SC בין שיטות טיפול בחלקיקים. הדגם, המתואר על ידי אנטוניה הופנגל ועמיתים ב פיזיקה רפואית, ניתן בסופו של דבר לשלב במערכות תכנון טיפול כדי לכלול סיכון SC כקריטריון אופטימיזציה נוסף.
אירועים קטלניים לעומת מסרטנים
מודלים של סיכון SC פועלים בדרך כלל על ידי התחשבות באיזון בין הרג תאים (המוביל לדיכוי סרטן) לבין טרנספורמציה של תאים (אינדוקציה של מוטציות שמובילות בסופו של דבר לסרטן). ההסתברות שנפח מוקרן יפתח סרטן מוגדרת באמצעות המודל ליניארי-מרובע (LQ), המספק קשר פשוט בין הישרדות התא ומינון הפוטון הנמסר.
במחקר זה, החוקרים השתמשו במודל ההשפעה המקומית (LEM) כדי לחזות את היעילות הביולוגית היחסית (RBE) של השראת SC לאחר טיפול בחלקיקים. כדי להסביר את ה-RBE המוגבר של קרינת החלקיקים, הם החליפו את פרמטרי הפוטון LQ במודל הסיכון בפרמטרי LQ של קרן יונים שנחזה על ידי LEM. מאפיין מרכזי בגישתם הוא השימוש ב-LEM הן במונחים של הרג תאים והן במונחים של השראת סרטן.

"השימוש הכפול ב-LEM משקף את התחרות בין שני התהליכים העיקריים הקובעים את התפתחות SC, כלומר טרנספורמציה של תאים והרג תאים", מסביר מחבר בכיר מייקל שולץ. "עם הגדלת המינון ו/או היעילות, הרג תאים יכול לדכא את הכדאיות של תאים שעברו טרנספורמציה. זה מוביל למשחק גומלין מורכב, שלא יכול להשתקף בצורה פשוטה אחרת בהליך חד-שלבי".
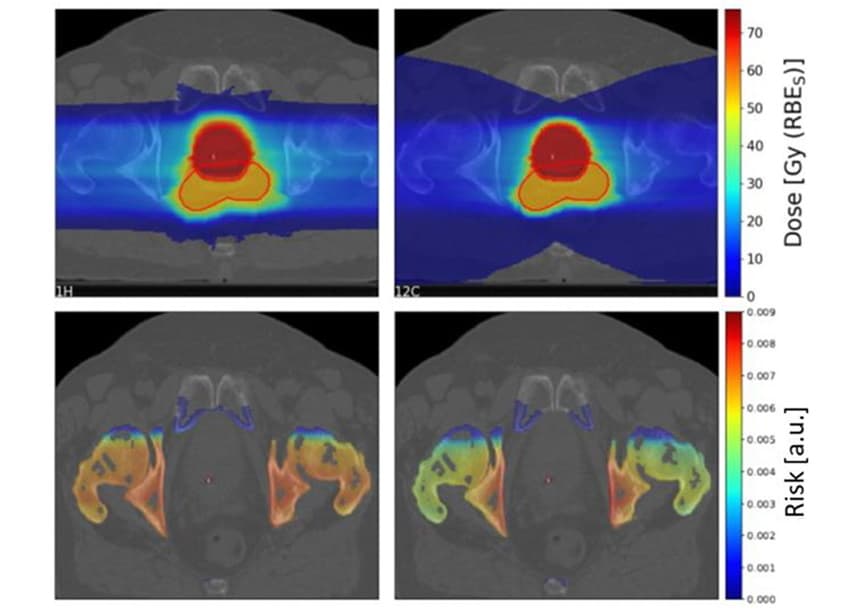
כדי לחקור אילו גורמים משפיעים על סיכון SC, החוקרים השתמשו במערכת התכנון TPS TRiP98 כדי ליצור תוכניות טיפול ביולוגיות אופטימליות של פחמן-יון ופרוטונים המבוססות על גיאומטריה אידיאלית. התוכניות הקרינו מטרה בגודל 4x4x4 ס"מ באמצעות קרן חלקיקים בודדת או שתי אלומות מנוגדות, עם איבר בסיכון של 4x4x1 ס"מ (OAR) לפני המטרה. בשל אי ודאות בפרמטרים של הפוטון LQ המשמשים כקלט עבור LEM, הם העריכו את יחסי הסיכון של פרוטון לפחמן, ולא ערכי סיכון בודדים.
עבור מערכים אידיאלים אלה, המודל לא הראה העדפה ברורה לא לפרוטונים ולא ליוני פחמן, אך חשף תלות מורכבת בפרמטרים שונים. הפיזור הרוחבי המופחת של יוני פחמן מוביל לסיכון SC נמוך יותר מאשר פרוטונים בערוץ הכניסה. עם זאת, יוני פחמן מפקידים מינון גבוה יותר מאחורי המטרה בגלל זנב הפיצול, מה שמגדיל את הסיכון ל-SC ל-OARs מאחורי הגידול לאחר הקרנת פחמן-יון.
עבור תוכניות קרן יחיד, הסיכון הכולל ל-SC היה גבוה בערך פי 1.5 עבור יוני פחמן מאשר עבור פרוטונים. עם שתי אלומות מנוגדות, הסיכון הכולל ל-SC היה גבוה פי 1.16 עבור פרוטונים, אם כי זה השתנה מאוד בהתאם למיקום המרחבי של הנפח הרגיש המשוער ביחס לנפח המטרה.
לרגישות לרדיו רקמות (לפוטונים) הייתה השפעה גדולה על יחס הסיכון ל-SC, כאשר OARs עמידים לרדיו נהנים מטיפול בפחמן-יון ו-OAR רגישים מקרני פרוטונים. לעומת זאת, לשיטת החלוקה הייתה השפעה מועטה על ערכי הסיכון הצפויים.
גיאומטריית המטופל
כדי לחקור תרחישים קליניים, Scholz ועמיתיו העריכו את הסיכונים ל-SC עבור 10 חולי סרטן הערמונית שטופלו בעבר בהקרנות פוטון בבית החולים האוניברסיטאי קרולינסקה. הם יצרו תוכניות טיפול עבור החולים באמצעות שני שדות פרוטונים ופחמן-יון סרוקים מנוגדים לרוחב.
כפי שנראה בעבר, זנב הפיצול של יוני פחמן הביא לאזור גדול במינון נמוך מאחורי המטרה. עם זאת, אזור היעד במינון גבוה היה תואם יותר עבור הפחמן-יון מאשר תוכניות הפרוטונים.
הצוות חישב את יחסי הסיכון של פרוטון ליון פחמן SC עבור ארבעה OARs (שלפוחית השתן, פי הטבעת, העצמות והעור) עבור 10 החולים. עבור עצם ועור, תוכניות פרוטונים הניבו סיכון SC מעט גבוה יותר מאשר תוכניות פחמן-יון, עם יחסי סיכון חציוניים של 1.19 ו-1.06 עבור עצם ועור, בהתאמה. עם זאת, עבור שלפוחית השתן והרקטום, תוכניות פרוטונים הביאו לסיכוני SC נמוכים משמעותית, עם יחסי סיכון של 0.68 ו-0.49 עבור שלפוחית השתן והרקטום, בהתאמה.
החוקרים מסכמים כי התובנות שהושגו במודל זה יכולות לסייע באופטימיזציה של טיפולים עתידיים. כיום, מודל סיכון יחסי מתאים בעיקר ככלי להשוואת תרחישי טיפול שונים עבור קבוצות חולים שונות. אבל Scholz מציין כי שילוב מודלים כאלה בתכנון הטיפול עבור מטופלים בודדים יהיה פשוט.

טיפול ברשת יוני פחמן חוסך רקמות בריאות
"זה רק דורש להפעיל את התכנון של התפלגות מינון נתונה עם שתי ערכות פרמטרים ביולוגיות שונות המייצגות את הרג התא ואת תהליך הטרנספורמציה של התא, בהתאמה", הוא מסביר. "לאחר מכן, נדרש רק עיבוד אחר של התפלגויות אפקט התלת-ממד המתקבלות עם כלים מתמטיים סטנדרטיים כדי לגזור את התפלגות יחס הסיכון המתאימות."
השלב הבא, הוא אומר, הוא לאמת את המודל באמצעות השוואה לנתונים קליניים. "מכיוון שכרגע הנתונים הללו נדירים, הרחבת הגישה לכלול גם טיפולי פוטון וקביעת יחסי הסיכון התואמים של פרוטונים מול פוטונים ויוני פחמן מול פוטונים תהיה צעד חשוב הבא," אומר שולץ עולם הפיזיקה.