By Kenna Hughes-Castleberry geplaatst op 07 okt 2022
Veel vergelijkingen binnen de kwantumfysica kunnen nuttig zijn voor het begeleiden van onderzoekers die kijken naar chemische interacties. Zowel kwantumfysica als chemie werken op dezelfde atomaire niveaus, worden ze vaak samen met elkaar gebruikt om nieuwe resultaten te bereiken. Onlangs hebben onderzoekers van de Los Alamos National Laboratory (LANL) ging nog een stap verder met deze koppeling door toe te voegen machine learning processen om biochemische interactie in moleculaire simulaties te helpen voorspellen. Dit zou op zijn beurt kunnen helpen bij het versnellen van stappen in het ontwerpen van geneesmiddelen en andere industriescenario's, waardoor geneesmiddelen op de lange termijn veiliger en sneller worden.
Machine Learning gebruiken voor datasets
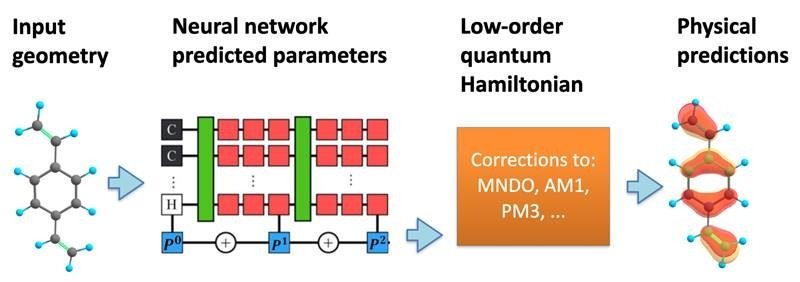
Er worden al machine learning-processen uitgevoerd toegepast tot kwantumcomputing en kwantumfysica. Omdat machine learning patronen voorspelt en creëert uit grote groepen gegevens, is het gunstig voor gebieden als kwantumfysica of scheikunde, die veel bewegende delen hebben. Volgens LANL-onderzoeker Benjamin Nebgen: “vóór de opkomst van machine learning (ML)-methoden op het gebied van chemie en materiaalkunde, was de grootste praktische simulatie van chemie en materiaalsystemen beperkt tot een paar duizend atomen. Dit is veel te klein om veel effecten nauwkeurig vast te leggen die chemische of materiële eigenschappen dicteren, zoals graanroutes of zeldzame reactieve routes. Dankzij de voordelen van machine learning kunnen onderzoekers meer gecompliceerde scenario's bestuderen in simulaties, waaronder die gericht op kwantumfysica en scheikunde.
Voor wetenschappers die nieuwe ontwerpen drugs of het bestuderen van chemische reacties, is het belangrijk om volledig te begrijpen wat er gebeurt met de elektronen op kwantumniveau. "De beweging van elektronen en atoomkernen regelt bijna alle chemische en materiële eigenschappen die ons moderne bestaan bepalen", zei Nebgen. "Dit omvat de chemie van alles, van de medicijnen die we gebruiken, de huishoudelijke schoonmaakmiddelen die we dagelijks gebruiken, tot de brandstoffen in onze eigen auto's en vrachtwagens. Verder worden de eigenschappen van materialen waaruit onze auto's, huizen, gereedschappen, vliegtuigen en bijna alles waar we dagelijks mee omgaan, bepaald door dezelfde onderliggende fysica. Dit stelt onderzoekers in staat om dieper in te gaan op de interacties van een molecuul op een fundamenteel niveau. Zodra dit niveau echter is bereikt, volgt er meer gecompliceerde wiskunde. "De krachten die op individuele atomen inwerken en die in de vergelijkingen van Newton terechtkomen, zijn afgeleid van de beweging van elektronen, die inherent kwantum van aard zijn", legt Nebgen uit. "Dus moeten de elektronen worden behandeld met de Schrödingervergelijking, wat een veel uitdagender wiskundig probleem is om op te lossen."
LANL gebruikt machine learning om modellen te maken
Om deze moeilijke vergelijkingen te overwinnen, gebruiken onderzoekers zoals Nebgen tools voor machinaal leren. Deze tools kunnen een chemische simulatie versnellen door zich te concentreren op slechts enkele van de belangrijkste elektronen in het systeem, voegde Nebgen eraan toe. Met behulp van een machine learning-tool, een neuraal netwerk genaamd, konden Nebgen en zijn team een voorspellend model van de mogelijke elektronentoestanden en hun bijbehorende energieën binnen een molecuul. Van daaruit kon het team nauwkeurig enkele van de mogelijke uitkomsten van de simulatie voorspellen, gegeven verschillende inputs. Voor biotechbedrijven die miljoenen dollars uitgeven aan het ontwerpen en testen van nieuwe medicijnen, kunnen voorspellende modellen zoals deze veel kosteneffectieve voordelen opleveren. Hoewel het gebruik van machine learning in de geneesmiddelenindustrie niet nieuw is, kan de combinatie ervan met de kracht van kwantumcomputing de volgende generatie technologie creëren die nodig is om toekomstige geneesmiddelen te lanceren.
Kenna Hughes-Castleberry is een stafschrijver bij Inside Quantum Technology en de Science Communicator bij JILA (een samenwerking tussen de University of Colorado Boulder en NIST). Haar schrijfritmes omvatten deep tech, de metaverse en kwantumtechnologie.