Deeltjestherapie – de behandeling van kanker met behulp van bundels protonen of zwaardere ionen – zorgt voor een zeer conforme dosisafgifte en een grotere spaarzaamheid voor normaal weefsel dan conventionele, op fotonen gebaseerde radiotherapie. Maar voor overlevenden van kanker op de lange termijn is het risico op door straling geïnduceerde secundaire kanker (SC) belangrijk, en hiermee moet rekening worden gehouden bij het selecteren van hun behandelingsmodaliteit.
Omdat epidemiologische gegevens schaars zijn voor nieuwere behandelingen zoals protonen- en koolstofionentherapie, leidde een team bij de GSI Helmholtz Centrum voor onderzoek naar zware ionen ontwikkelt een model om de SC-risico's tussen deeltjestherapiemodaliteiten te vergelijken. Het model, beschreven door Antonia Hufnagl en collega's in Medische Fysica, zou uiteindelijk kunnen worden opgenomen in behandelingsplanningssystemen om SC-risico op te nemen als een aanvullend optimalisatiecriterium.
Dodelijke versus kankerverwekkende gebeurtenissen
SC-risicomodellen werken doorgaans door rekening te houden met de balans tussen celdoding (leidend tot kankeronderdrukking) en celtransformatie (inductie van mutaties die uiteindelijk tot kanker leiden). De waarschijnlijkheid dat een bestraald volume kanker zal ontwikkelen, wordt gedefinieerd met behulp van het lineair-kwadratische (LQ) model, dat een eenvoudige relatie biedt tussen celoverleving en de afgeleverde fotondosis.
In deze studie gebruikten de onderzoekers het lokale effectmodel (LEM) om de relatieve biologische effectiviteit (RBE) van SC-inductie na deeltjestherapie te voorspellen. Om rekening te houden met de verhoogde RBE van deeltjesstraling, hebben ze de foton-LQ-parameters in het risicomodel vervangen door de ionenbundel-LQ-parameters voorspeld door de LEM. Een belangrijk kenmerk van hun aanpak is het gebruik van de LEM in termen van zowel celdoding als kankerinductie.

“Het dubbele gebruik van de LEM weerspiegelt de concurrentie tussen de twee belangrijkste processen die de ontwikkeling van SC bepalen, namelijk celtransformatie en celdoding”, legt senior auteur uit. Michaël Scholz. “Met toenemende dosis en/of effectiviteit kan celdoding de levensvatbaarheid van getransformeerde cellen onderdrukken. Dit leidt tot een complex samenspel, dat niet zomaar in een eenstapsprocedure kan worden weerspiegeld.”
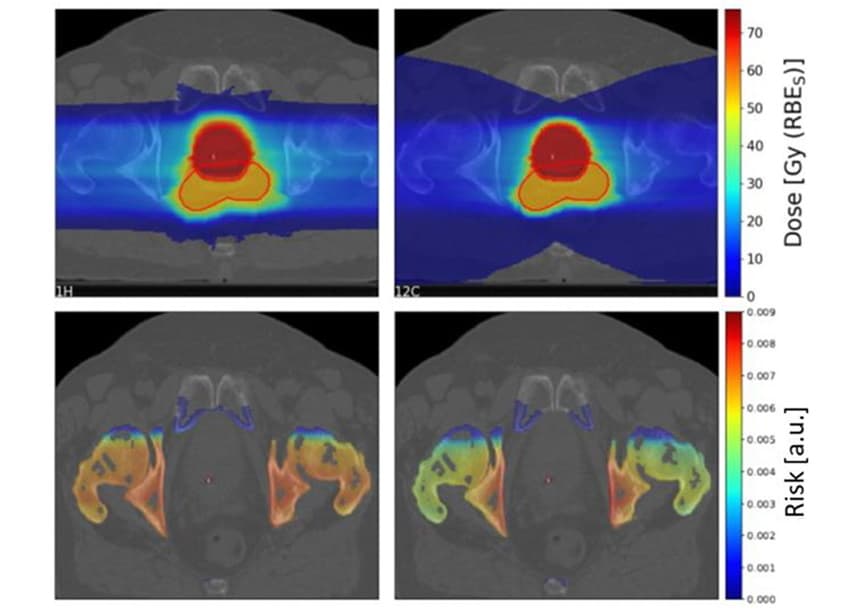
Om te onderzoeken welke factoren van invloed zijn op het SC-risico, gebruikten de onderzoekers het TPS TRiP98-planningssysteem om biologisch geoptimaliseerde behandelplannen voor koolstofionen en protonen te genereren op basis van een geïdealiseerde geometrie. De plannen bestraalden een doel van 4x4x4 cm met een enkele deeltjesbundel of twee tegengestelde stralen, met een orgel-at-risk (OAR) van 4x4x1 cm voor het doel. Vanwege onzekerheden in de foton-LQ-parameters die als input voor de LEM werden gebruikt, schatten ze de risicoverhoudingen van protonen tot koolstofionen, in plaats van individuele risicowaarden.
Voor deze geïdealiseerde opstellingen vertoonde het model geen duidelijke voorkeur voor protonen of koolstofionen, maar onthulde het een complexe afhankelijkheid van verschillende parameters. De verminderde laterale verstrooiing van koolstofionen leidt tot een lager SC-risico dan protonen in het ingangskanaal. Koolstofionen zetten echter een hogere dosis achter het doel af vanwege de fragmentatiestaart, waardoor het SC-risico voor OAR's achter de tumor na bestraling met koolstofionen toeneemt.
Voor plannen met één bundel was het totale SC-risico ongeveer 1.5 keer hoger voor koolstofionen dan voor protonen. Met twee tegengestelde bundels was het totale SC-risico 1.16 keer hoger voor protonen, hoewel dit sterk varieerde afhankelijk van de ruimtelijke locatie van het veronderstelde gevoelige volume ten opzichte van het doelvolume.
De radiogevoeligheid van weefsel (voor fotonen) had een grote invloed op de SC-risicoverhouding, waarbij radioresistente OAR's profiteerden van behandeling met koolstofionen en gevoelige OAR's van protonenbundels. Het fractioneringsschema had daarentegen weinig invloed op de verwachte risicowaarden.
Patiëntgeometrie
Om klinische scenario's te onderzoeken, schatten Scholz en collega's de SC-risico's voor 10 prostaatkankerpatiënten die eerder werden behandeld met fotonenradiotherapie in het Karolinska Universitair Ziekenhuis. Ze genereerden behandelplannen voor de patiënten met behulp van twee zijdelings tegenover elkaar gelegen gescande protonen- en koolstofionenvelden.
Zoals eerder gezien resulteerde de fragmentatiestaart van koolstofionen in een groot gebied met lage dosis achter het doel. Het doelgebied met hoge dosis was echter conformer voor het koolstofion dan voor de protonenplannen.
Het team berekende de SC-risicoverhoudingen tussen protonen en koolstofionen voor vier OAR's (blaas, rectum, botten en huid) voor de 10 patiënten. Voor bot en huid leverden protonenplannen een iets hoger SC-risico op dan koolstofionenplannen, met mediane risicoverhoudingen van respectievelijk 1.19 en 1.06 voor bot en huid. Voor blaas en rectum resulteerden protonenplannen echter in significant lagere SC-risico's, met risicoratio's van respectievelijk 0.68 en 0.49 voor blaas en rectum.
De onderzoekers concluderen dat de inzichten die dit model oplevert, toekomstige behandelingen kunnen helpen optimaliseren. Momenteel is relatieve risicomodellering vooral geschikt als hulpmiddel voor het vergelijken van verschillende behandelscenario’s voor verschillende patiëntencohorten. Maar Scholz merkt op dat het opnemen van dergelijke modellen in de behandelplanning voor individuele patiënten eenvoudig zou zijn.

Koolstofionenroostertherapie spaart gezond weefsel
"Het vereist alleen maar het uitvoeren van de planning voor een gegeven dosisverdeling met twee verschillende biologische parametersets die respectievelijk het celdodende en het celtransformatieproces vertegenwoordigen", legt hij uit. "Dan is er slechts enige nabewerking van de resulterende 3D-effectverdelingen met standaard wiskundige hulpmiddelen nodig om de overeenkomstige risicoverhoudingsverdelingen af te leiden."
De volgende stap, zegt hij, is het valideren van het model door vergelijking met klinische gegevens. “Aangezien deze gegevens momenteel schaars zijn, zou uitbreiding van de aanpak om ook fotonbehandelingen te omvatten en het bepalen van de overeenkomstige risicoverhoudingen van protonen versus fotonen en koolstofionen versus fotonen een belangrijke volgende stap zijn”, vertelt Scholz. Natuurkunde wereld.