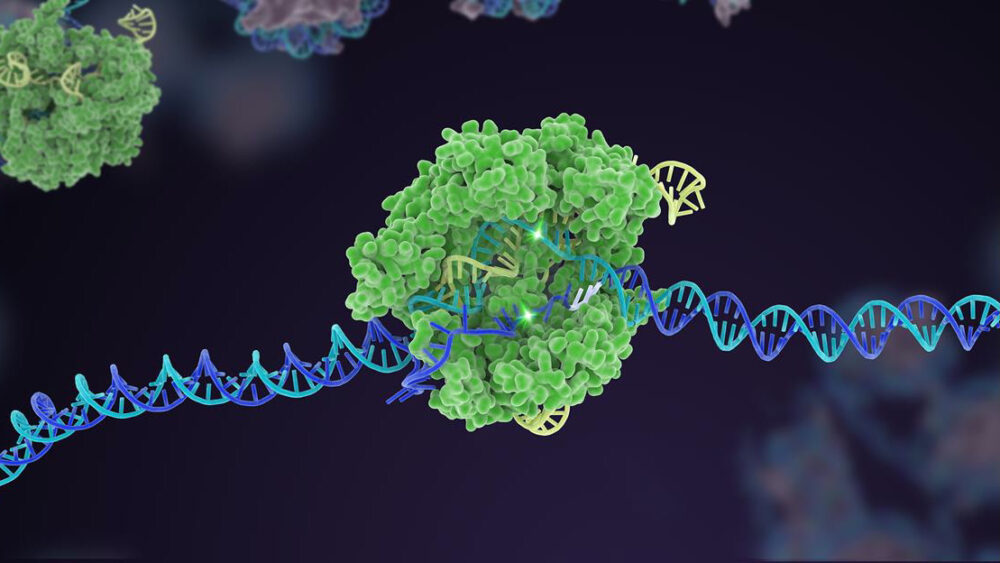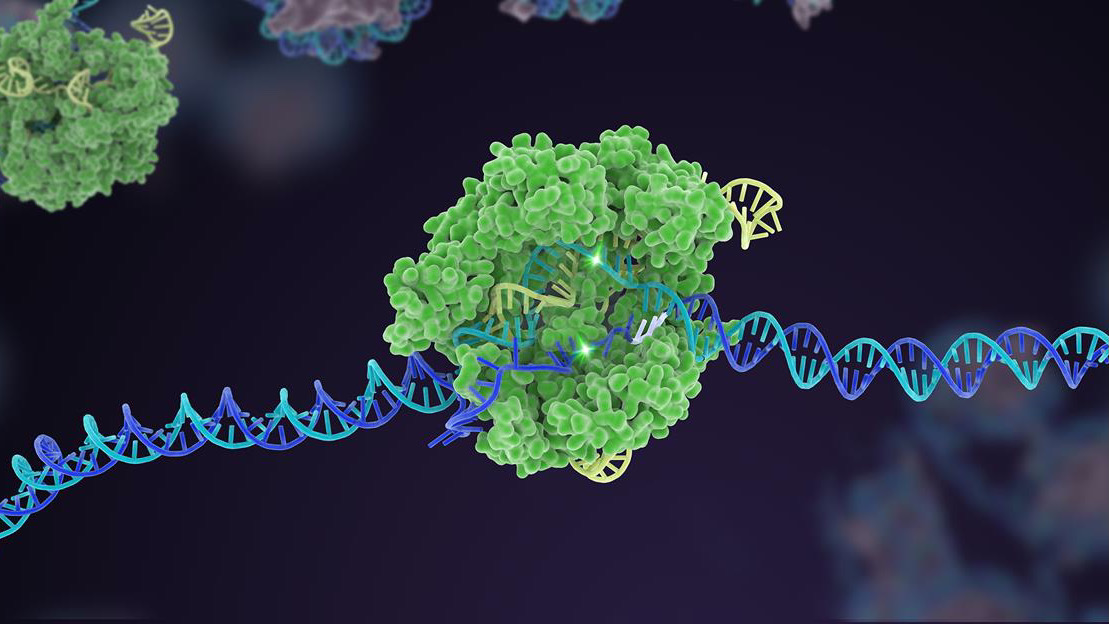
For ti år siden skjøt en lite kjent bakteriell forsvarsmekanisme til himmels til berømmelse som en kraftig genomredaktør. I tiåret siden har CRISPR-Cas9 spunnet ut flere varianter, og utvidet seg til en omfattende verktøykasse som kan redigere livets genetiske kode.
Langt fra en jakt i elfenbenstårn, kom dens praktiske bruk i forskning, helsevesen og landbruk raskt og rasende.
Du har sett overskriftene. FDA godkjente bruken i takle den underliggende genetiske mutasjonen for sigdcellesykdom. Noen forskere redigerte immunceller for å bekjempe blodkreft som ikke kan behandles hos barn. Andre tok organtransplantasjoner fra gris til menneske fra drøm til virkelighet i et forsøk på å dempe mangelen på donororganer. Nylig arbeid tar sikte på å hjelpe millioner av mennesker med høyt kolesterol – og potensielt bringe CRISPR-basert genterapi til massene – ved å redusere sjansene for hjertesykdom med en enkelt injeksjon.
Men til Dr. Jennifer Doudna, som vant Nobelprisen i 2020 for sin rolle i utviklingen av CRISPR, vi skraper bare i overflaten av potensialet. Sammen med doktorgradsstudent Joy Wang la Doudna et veikart for teknologiens neste tiår i en artikkel in Vitenskap.
Hvis 2010-tallet var fokusert på å etablere CRISPR-verktøykassen og bevise dens effektivitet, er dette tiåret når teknologien når sitt fulle potensial. Fra CRISPR-baserte terapier og storskala skjermer for sykdomsdiagnostikk til utvikling av avlinger med høy avkastning og næringsrik mat, teknologien "og dens potensielle innvirkning er fortsatt i sine tidlige stadier," skrev forfatterne.
Et tiår med høydepunkter
Vi har sølt mye blekk på CRISPR-fremskritt, men det lønner seg å gå tilbake til fortiden for å forutsi fremtiden – og potensielt lete etter problemer underveis.
Et tidlig høydepunkt var CRISPRs utrolige evne til raskt å konstruere dyremodeller for sykdom. Dens opprinnelige form klipper lett bort et målrettet gen i et veldig tidlig embryo, som når det transplanteres inn i en livmor kan generere genmodifiserte mus på bare en måned, sammenlignet med et år ved bruk av tidligere metoder. Ytterligere CRISPR-versjoner, for eksempel basisredigering – bytte av en genetisk bokstav med en annen – og førstegangsredigering – som klipper DNA-et uten å kutte begge trådene – økte verktøysettets fleksibilitet ytterligere ved å konstruere genetisk endrede organoider (tenk minihjerner) og dyr. CRISPR etablerte raskt dusinvis av modeller for noen av våre mest ødeleggende og forvirrende sykdommer, inkludert ulike kreftformer, Alzheimers og Duchennes muskeldystrofi – en degenerativ lidelse der muskelen sakte forsvinner. Dusinvis av CRISPR-baserte forsøk er nå i verkene.
CRISPR akselererte også genetisk screening inn i big data-alderen. I stedet for å målrette ett gen om gangen, er det nå mulig å dempe, eller aktivere, tusenvis av gener parallelt, og danne en slags Rosetta-stein for å oversette genetiske forstyrrelser til biologiske endringer. Dette er spesielt viktig for å forstå genetiske interaksjoner, slik som de i kreft eller aldring som vi ikke tidligere var kjent med, og for å få ny ammunisjon for utvikling av medikamenter.
Men en kronen på verket for CRISPR var multipleks redigering. Som å trykke på flere pianotangenter samtidig, retter denne typen genteknologi seg mot flere spesifikke DNA-områder, og endrer raskt genomets genetiske sammensetning på en gang.
Teknologien fungerer i planter og dyr. I evigheter har folk møysommelig avlet avlinger med ønskelige egenskaper – det være seg farge, størrelse, smak, ernæring eller motstandsdyktighet mot sykdom. CRISPR kan hjelpe med å velge etter flere egenskaper eller til og med tamme nye avlinger på bare én generasjon. CRISPR-genererte hornløse okser, næringsrike tomater, og hypermuskulære husdyr og fisk allerede er virkelighet. Med verdens befolkning når 8 milliarder i 2022 og millioner som lider av sult, CRISPRed-avlinger kan gi en livline – det vil si hvis folk er villige til å akseptere teknologien.
Stien frem
Hvor går vi hen herfra?
For forfatterne må vi ytterligere øke effektiviteten til CRISPR og bygge tillit. Dette betyr å gå tilbake til det grunnleggende for å øke verktøyets redigeringsnøyaktighet og presisjon. Her er plattformer for raskt å utvikle Cas-enzymer, "sakse"-komponenten i CRISPR-maskineriet, avgjørende.
Det har allerede vært suksesser: én Cas-versjon, Eksempelvis, fungerer som et rekkverk for målrettingskomponenten - sgRNA-"blodhunden". I klassisk CRISPR fungerer sgRNA alene, men i denne oppdaterte versjonen sliter det med å binde seg uten Cas-hjelp. Dette trikset hjelper til med å skreddersy redigeringen til et spesifikt DNA-sted og øker nøyaktigheten slik at kuttet fungerer som forutsagt.
Lignende strategier kan også øke presisjonen med færre bivirkninger eller sette inn nye gener i celler som nevroner og andre som ikke lenger deler seg. Selv om det allerede er mulig med prime-redigering, kan effektiviteten være det 30 ganger lavere enn klassiske CRISPR-mekanismer.
"Et hovedmål for prime-redigering i det neste tiåret er å forbedre effektiviteten uten å gå på akkord med redigeringsproduktets renhet - et resultat som har potensial til å gjøre prime-redigering til et av de mest allsidige verktøyene for presisjonsredigering," sa forfatterne.
Men kanskje viktigere er levering, som fortsatt er en flaskehals spesielt for terapeutika. For tiden brukes CRISPR vanligvis på celler utenfor kroppen som infunderes tilbake – som i tilfellet med CAR-T – eller i noen tilfeller bundet til en virusbærer eller innkapslet i fettbobler og injisert i kroppen. Det har vært suksesser: i 2021, godkjente FDA første CRISPR-baserte skudd å takle en genetisk blodsykdom, transthyretin amyloidose.
Likevel er begge strategiene problematiske: ikke mange typer celler kan overleve CAR-T-behandlingen – døende når de gjeninnføres i kroppen – og målretting mot spesifikke vev og organer forblir stort sett utenfor rekkevidde for injiserbare terapier.
Et viktig fremskritt for det neste tiåret, sa forfatterne, er å transportere CRISPR-lasten inn i det målrettede vevet uten å skade og frigjøre geneditoren på det tiltenkte stedet. Hvert av disse trinnene, selv om de tilsynelatende er enkle på papiret, presenterer sitt eget sett med utfordringer som vil kreve både bioteknologi og innovasjon for å overvinne.
Endelig kan CRISPR synergi med andre teknologiske fremskritt, sa forfatterne. For eksempel, ved å bruke celleavbildning og maskinlæring, kan vi snart konstruere enda mer effektive genomredigerere. Takk til raskere og billigere DNA-sekvensering, kan vi da enkelt overvåke konsekvensene for genredigering. Disse dataene kan da gi en slags tilbakemeldingsmekanisme for å konstruere enda kraftigere genomredigerere i en virtuous loop.
Virkelighet i verden
Selv om ytterligere utvidelse av CRISPR-verktøykassen er på agendaen, er teknologien tilstrekkelig moden til å påvirke den virkelige verden i det andre tiåret, sa forfatterne.
I nær fremtid bør vi se "et økt antall CRISPR-baserte behandlinger som flytter til senere stadier av kliniske studier." Ser vi lenger fremover, kan teknologien, eller dens varianter, gjøre gris-til-menneske organ xenotransplantasjoner rutine, snarere enn eksperimentelle. Storskala skjermer for gener som fører til aldring eller degenerative hjerne- eller hjertesykdommer – våre beste mordere i dag – kan gi profylaktiske CRISPR-baserte behandlinger. Det er ingen enkel oppgave: vi trenger både kunnskap om genetikken som ligger til grunn for mangefasetterte genetiske sykdommer – det vil si når flere gener spiller inn – og en måte å levere redigeringsverktøyene til målet deres. "Men de potensielle fordelene kan drive innovasjon på disse områdene langt utover det som er mulig i dag," sa forfatterne.
Men med større makt følger større ansvar. CRISPR har avansert i rasende fart, og reguleringsbyråer og publikum sliter fortsatt med å ta igjen. Det kanskje mest beryktede eksemplet var det CRISPR babyer, hvor eksperimenter utført mot globale etiske retningslinjer drevet et internasjonalt konsortium for å legge en rød linje for menneskelig kimcelleredigering.
På samme måte er genmodifiserte organismer (GMO) fortsatt et kontroversielt tema. Selv om CRISPR er langt mer presis enn tidligere genetiske verktøy, vil det være opp til forbrukerne å bestemme om de ønsker velkommen en ny generasjon menneskeskapte matvarer– både planter og dyr.
Disse er viktige samtaler som trenger global diskurs når CRISPR går inn i sitt andre tiår. Men for forfatterne ser fremtiden lys ut.
"Akkurat som under fremkomsten av CRISPR-genomredigering, vil en kombinasjon av vitenskapelig nysgjerrighet og ønsket om å være til nytte for samfunnet drive det neste tiåret med innovasjon innen CRISPR-teknologi," sa de. "Ved å fortsette å utforske den naturlige verden, vil vi oppdage det som ikke kan forestilles og sette det i bruk i den virkelige verden til fordel for planeten."
Bilde Credit: NIH
- SEO-drevet innhold og PR-distribusjon. Bli forsterket i dag.
- Platoblokkkjede. Web3 Metaverse Intelligence. Kunnskap forsterket. Tilgang her.
- kilde: https://singularityhub.com/2023/01/25/crisprs-wild-first-decade-only-scratches-the-surface-of-its-potential/
- 2020
- a
- evne
- akselerert
- Aksepterer
- nøyaktighet
- prestasjon
- handlinger
- Ytterligere
- avansere
- avansert
- fremskritt
- advent
- mot
- byråer
- agenda
- Aldring
- landbruk
- fremover
- mål
- lindre
- alene
- allerede
- Selv
- Alzheimers
- ammunisjon
- og
- dyr
- dyr
- godkjent
- områder
- Assistanse
- forfattere
- tilbake
- basen
- Grunnleggende
- nytte
- Fordeler
- Berkeley
- Beyond
- Stor
- Store data
- Milliarder
- binde
- blod
- Bloomberg
- kroppen
- øke
- styrket
- Brain
- bringe
- bygge
- bygge tillit
- Kreft
- kan ikke
- saken
- saker
- Catch
- Celler
- utfordringer
- sjansene
- Endringer
- endring
- billigere
- Classic
- Klinisk
- kliniske studier
- kode
- farge
- kombinasjon
- Kom
- sammenlignet
- komponent
- omfattende
- kompromittere
- Konsekvenser
- konsortium
- Forbrukere
- fortsetter
- kontroversiell
- samtaler
- kunne
- kreditt
- CRISPR
- kritisk
- avlinger
- nysgjerrighet
- I dag
- Kutt
- skjæring
- dato
- tiår
- Forsvar
- leverer
- levering
- utvikle
- Utvikling
- oppdage
- sykdom
- sykdommer
- dna
- ned
- dusinvis
- drøm
- stasjonen
- medikament
- under
- hver enkelt
- Tidlig
- lett
- redaktør
- effektivitet
- effekter
- effektivitet
- effektiv
- innkapslet
- ingeniør
- Ingeniørarbeid
- Går inn
- spesielt
- etablert
- etablere
- etisk
- Selv
- utvikle seg
- eksempel
- ekspanderende
- utforske
- FAME
- gård
- FAST
- FDA
- tilbakemelding
- slåss
- Først
- fleksibilitet
- fokuserte
- mat
- skjema
- fra
- fullt
- videre
- framtid
- få
- generelt
- generere
- generasjonen
- genteknologi
- genetikk
- Global
- Go
- mål
- skal
- oppgradere
- større
- retningslinjer
- Overskrifter
- helsetjenester
- Hjerte
- hjelpe
- hjelper
- her.
- Høy
- Uthev
- HTTPS
- menneskelig
- Imaging
- Påvirkning
- viktig
- bedre
- in
- Inkludert
- Øke
- økt
- øker
- utrolig
- Innovasjon
- interaksjoner
- internasjonalt
- IT
- Jennifer
- bare én
- nøkkel
- nøkler
- killers
- Type
- kunnskap
- storskala
- føre
- læring
- låne
- brev
- Life
- linje
- lenger
- ser
- UTSEENDE
- maskin
- maskinlæring
- maskiner
- Hoved
- gjøre
- sminke
- mange
- moden
- midler
- mekanisme
- metoder
- millioner
- modeller
- modifisert
- Overvåke
- Måned
- mer
- mer effektivt
- mest
- flytting
- mangesidig
- flere
- Naturlig
- Natur
- Nær
- Trenger
- Nerveceller
- Ny
- neste
- NHS
- NIH
- Nobel pris
- notorisk
- Antall
- ONE
- original
- Annen
- andre
- utenfor
- Overcome
- egen
- Papir
- Parallel
- Past
- banen
- land
- porsjoner
- kanskje
- planet
- Hvordan få de til å trives
- Plattformer
- plato
- Platon Data Intelligence
- PlatonData
- Plenty
- befolkningen
- mulig
- potensiell
- potensielt
- makt
- kraftig
- Praktisk
- Precision
- forutsi
- spådd
- gaver
- forrige
- tidligere
- Prime
- premie
- problemer
- Produkt
- gi
- offentlig
- sette
- raskt
- å nå
- Når
- ekte
- virkelige verden
- Reality
- nylig
- Rød
- regulatorer
- slipp
- forbli
- forblir
- krever
- forskning
- forskere
- resiliens
- ansvar
- Rich
- veikart
- Rolle
- Sa
- Vitenskap
- Scout
- screening
- skjermer
- Sekund
- sett
- mangel
- bør
- side
- Silence
- Enkelt
- samtidig
- siden
- enkelt
- nettstedet
- Størrelse
- Sakte
- So
- Samfunnet
- noen
- spesifikk
- fart
- Spot
- spunnet
- stadier
- Steps
- Still
- STONE
- strategier
- kamper
- Sliter
- Student
- slik
- lidelse
- overflaten
- overleve
- Target
- målrettet
- rettet mot
- mål
- Oppgave
- teknologisk
- Teknologi
- De
- Grunnleggende
- verden
- deres
- terapeutika
- tusener
- tid
- ganger
- til
- i dag
- sammen
- Toolbox
- verktøy
- topp
- Tema
- Tårn
- forsøk
- Stol
- SVING
- typer
- UN
- underliggende
- forståelse
- oppdatert
- bruke
- ulike
- allsidig
- versjon
- velkommen
- Hva
- Hva er
- om
- hvilken
- mens
- HVEM
- Wild
- vil
- villig
- uten
- Vant
- Arbeid
- virker
- verden
- år
- år
- Utbytte
- zephyrnet