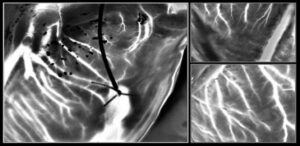
Evnen til å slå sammen elektronikk og optiske sensorer med menneskekroppen på enkeltcellenivå kan en dag muliggjøre fjernovervåking og kontroll av individuelle celler i sanntid. Fremskritt innen elektronikkproduksjon har gjort det mulig å lage transistorer og sensorer med nanoskalaoppløsning, mens innovative nanomønsterteknikker muliggjør montering av disse enhetene på fleksible underlag. Slike prosesser krever imidlertid generelt sterke kjemikalier, høye temperaturer eller vakuumteknikker som er uegnet for levende celler og vev.
For å overvinne disse hindringene har et forskerteam ved Johns Hopkins University utviklet en ikke-giftig, høyoppløselig og kostnadseffektiv prosess for å skrive ut gullnanomønstre på levende vev og celler. Rapportere funnene sine i Nano Letters, demonstrerer de at den nye teknikken kan "tatovere" levende celler og vev med fleksible arrayer av gullnanodotter og nanotråder. Til syvende og sist kan metoden brukes til å integrere smarte enheter med levende vev for applikasjoner som bionikk og biosensing.
"Hvis vi hadde teknologier for å spore helsen til isolerte celler, kunne vi kanskje diagnostisert og behandlet sykdommer mye tidligere og ikke ventet til hele organet er skadet," forklarer teamleder David Gracias i en pressemelding. «Vi snakker om å sette noe som en elektronisk tatovering på et levende objekt som er titalls ganger mindre enn hodet på en nål. Det er det første skrittet mot å feste sensorer og elektronikk på levende celler."
Takk, Luo Gu og kolleger har designet en tre-trinns nanotransfer utskriftsprosess for å binde gull nanomønstre til levende celler. I det første trinnet brukte de konvensjonell nanoimprint litografi (NIL) for å skrive ut arrays av gullnanodotter eller nanotråder på polymerbelagte silisiumskiver. De løste deretter opp polymeren, og frigjorde nanoarrayene for overføring til dekkglass.
Deretter funksjonaliserte forskerne gulloverflaten med cysteamin og belagt gull-NIL-arrayene med et alginathydrogeloverføringslag. De viste at denne tilnærmingen pålitelig kunne overføre 8 × 8 mm rekker av nanodotter og nanotråder fra glasset til de myke og fleksible hydrogelene. I det siste trinnet blir gull-NIL-arrayene konjugert med gelatin for å muliggjøre overføring til levende celler eller vev. Å dissosiere hydrogeloverføringslaget avslører deretter gullmønsteret.
Forskerne undersøkte oppførselen til levende fibroblastceller sådd på arrays med 250 nm-diameter gullprikker (550 nm senter-til-senter avstand) eller 300 nm brede gulltråder (450 nm avstand) på alginathydrogeler. Rundt 24 timer etter såing migrerte celler på den nanotråd-trykte hydrogelen fortrinnsvis parallelt med nanotrådene, mens de på nanoprikkene viste tilfeldig, men litt raskere, migrasjon. Celler på nanotrådene viste også omtrent dobbelt så lang forlengelse av de på nanodottene. Disse funnene viser evnen til gull-NIL-arrayene til å veilede celleorientering og migrasjon.
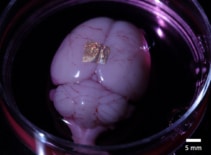
I tillegg til å være biokompatibel med celler og vev, kan alginathydrogel også overføre gull NIL-arrayer til levende organer og celler. For å demonstrere dette, plasserte forskerne nanotråd-trykte hydrogeler på hjernebarken til en hel hjerne og en koronal hjerneskive.
Etter 2 timer i kulturmedier og dissosiasjon av hydrogelen, forble nanotrådene bundet til overflaten av hele hjernen. Derimot festet seg ikke nanotråder på hjerneskiven, noe som tyder på at adhesjonsstyrken varierer mellom ulike celletyper og kulturmetoder. Forskerne bemerker at ytterligere studier er nødvendig for å karakterisere og optimalisere adhesjonsmekanismer for robust langsiktig binding.
Til slutt, for å vurdere biooverføringsutskrift på enkeltcellenivå, dyrket forskerne monolagcelleark på gull NIL-array-trykte alginathydrogeler. Etter 24 timer snudde de de fibroblastfrøede hydrogelene på gelatinbelagte dekkglass og lot cellene feste seg til dekkglassene over natten.
Etter å ha dissosiert alginathydrogelen, avslørte fluorescensmikroskopi at fibroblaster mønstret med gullnanodotter hadde en levedyktighet på omtrent 97 %, mens de mønstret med nanotråder hadde en levedyktighet på omtrent 98 %, noe som indikerer at utskriftsprosessen er biokompatibel med levende celler. Reflekterende farger sett på det mønstrede fibroblastcellearket antyder at formen til gull-NIL-arrayen ble beholdt.
Produksjonsprosessen er også kompatibel med mikroskala fotolitografi, som gjorde det mulig for forskerne å lage 200 µm brede sekskantede og trekantede flekker av gull NIL-arrayer. De deretter biotransfer trykte disse på celleark, noe som førte til selektiv vekst av fibroblastceller på mikrolappene. Filmer tatt opp over 16 timer viste at celler med flekker av nanotråder trykt på toppen virket sunne og i stand til å migrere, med arrayene igjen på de myke cellene selv mens de beveget seg.

Liten sensor måler samtidig elektrisk og mekanisk aktivitet i hjerteceller
"Vi har vist at vi kan feste komplekse nanomønstre til levende celler, samtidig som vi sikrer at cellen ikke dør," sier Gracias. "Det er et veldig viktig resultat at cellene kan leve og bevege seg med tatoveringene fordi det ofte er en betydelig inkompatibilitet mellom levende celler og metodene ingeniører bruker for å fremstille elektronikk."
Gracias og kolleger konkluderer med at deres nanomønsterprosess, kombinert med standard mikrofabrikasjonsteknikker, "åpner muligheter for utvikling av nye cellekultursubstrater, biohybridmaterialer, bioniske enheter og biosensorer". Deretter planlegger de å prøve å feste mer komplekse nanokretser som kan holde seg på plass i lengre perioder, samt eksperimentere med ulike typer celler.
- SEO-drevet innhold og PR-distribusjon. Bli forsterket i dag.
- PlatoData.Network Vertical Generative Ai. Styrk deg selv. Tilgang her.
- PlatoAiStream. Web3 Intelligence. Kunnskap forsterket. Tilgang her.
- PlatoESG. Bil / elbiler, Karbon, CleanTech, Energi, Miljø, Solenergi, Avfallshåndtering. Tilgang her.
- PlatoHelse. Bioteknologisk og klinisk etterretning. Tilgang her.
- ChartPrime. Hev handelsspillet ditt med ChartPrime. Tilgang her.
- BlockOffsets. Modernisering av eierskap for miljøkompensasjon. Tilgang her.
- kilde: https://physicsworld.com/a/researchers-tattoo-gold-nanopatterns-onto-live-cells/
- : har
- :er
- :ikke
- $OPP
- 16
- 200
- 24
- 8
- a
- evne
- I stand
- Om oss
- aktivitet
- overholde
- fremskritt
- Etter
- også
- blant
- an
- og
- dukket opp
- søknader
- tilnærming
- ca
- ER
- rundt
- Array
- AS
- Montering
- vurdere
- At
- feste
- BE
- fordi
- være
- mellom
- kroppen
- obligasjon
- Brain
- men
- CAN
- Celler
- karakter
- klikk
- kollegaer
- kombinert
- kompatibel
- komplekse
- konkluderer
- kontrast
- kontroll
- konvensjonell
- kostnadseffektiv
- kunne
- skape
- Kultur
- dag
- demonstrere
- designet
- utviklet
- Utvikling
- Enheter
- gJORDE
- Die
- forskjellig
- sykdommer
- ikke
- Tidligere
- elektronisk
- Elektronikk
- muliggjøre
- aktivert
- Ingeniører
- sikrer
- Hele
- Selv
- forklarer
- raskere
- slutt~~POS=TRUNC
- funn
- Først
- fleksibel
- Til
- fra
- videre
- GAO
- generelt
- glass
- Gull
- Vekst
- veilede
- HAD
- Ha
- hode
- Helse
- sunt
- Hjerte
- Høy
- høy oppløsning
- Hopkins
- Men
- HTTPS
- menneskelig
- bilde
- viktig
- in
- individuelt
- informasjon
- innovative
- integrere
- isolert
- utstedelse
- IT
- johns
- Johns Hopkins University
- jpg
- lag
- leder
- ledende
- la
- Nivå
- i likhet med
- leve
- levende
- langsiktig
- lenger
- laget
- materialer
- max bredde
- kan være
- målinger
- mekanisk
- mekanismer
- Media
- Flett
- metode
- metoder
- mikros~~POS=TRUNC
- migrere
- migrert
- migrasjon
- overvåking
- mer
- flytte
- flyttet
- Filmer
- mye
- nødvendig
- Ny
- neste
- objekt
- hindringer
- of
- ofte
- on
- ONE
- videre til
- åpen
- Muligheter
- Optimalisere
- or
- enn
- Overcome
- over natten
- Parallel
- Patches
- Mønster
- perioder
- Fysikk
- Fysikkens verden
- Sted
- fly
- plato
- Platon Data Intelligence
- PlatonData
- posisjonert
- mulig
- trykk
- Skrive ut
- utskrift
- prosess
- Prosesser
- Sette
- tilfeldig
- ROTTE
- ekte
- sanntids
- registrert
- forble
- gjenværende
- fjernkontroll
- Rapportering
- krever
- forskning
- forskere
- oppløsning
- resultere
- Avslørt
- robust
- omtrent
- sier
- sett
- selektiv
- sensorer
- Form
- ark
- viste
- vist
- signifikant
- Silicon
- samtidig
- Slice
- mindre
- Smart
- Soft
- noe
- Standard
- Uttalelse
- opphold
- Trinn
- styrke
- studier
- slik
- foreslår
- overflaten
- snakker
- lag
- teknikker
- Technologies
- titus
- enn
- Det
- De
- deres
- deretter
- Disse
- de
- denne
- De
- thumbnail
- tid
- ganger
- til
- topp
- mot
- spor
- overføre
- behandle
- sant
- prøve
- To ganger
- typer
- Til syvende og sist
- universitet
- til
- bruke
- brukt
- Vakuum
- veldig
- levedyktighet
- vente
- var
- we
- VI VIL
- mens
- hvilken
- mens
- hele
- bred
- med
- verden
- zephyrnet