Introduksjon
Våre minner er hjørnesteinen i vår identitet. Deres betydning er en stor del av det som gjør Alzheimers sykdom og andre former for demens så grusomme og gripende. Det er derfor vi har håpet så desperat på at vitenskapen skal levere en kur mot Alzheimers, og hvorfor det er så frustrerende og tragisk at nyttige behandlinger har vært sakte med å dukke opp. Stor begeistring omringet derfor kunngjøringen i september om at et nytt medikament, lecanemab, bremset utviklingen av sykdommen i kliniske studier. Hvis det blir godkjent av Food and Drug Administration, vil lecanemab bli bare den andre Alzheimer-behandlingen som motvirker amyloid-beta-protein, som i stor grad antas å være årsaken til sykdommen.
Likevel er effekten av lecanemab så marginal at forskere diskuterer om stoffet virkelig vil gjøre en praktisk forskjell for pasientene. Det faktum at lecanemab skiller seg ut som et lyspunkt forteller hvor dyster mye av historien til forskning på behandlinger for Alzheimers har vært. I mellomtiden gir en dypere forståelse av biologien i spill interesse for de ledende alternative teoriene for hva som forårsaker sykdommen.
Spekulasjonene om hvordan hukommelsen fungerer er minst like gamle som Platon, som i en av sine sokratiske dialoger skrev om «minnets gave, musenes mor», og sammenlignet driften med et voksstempel i sjelen. Vi kan være takknemlige for at vitenskapen har forbedret vår forståelse av hukommelsen betydelig siden Platons tid - ut med voksstemplene, inn med "engrammer" av endringer i nevronene våre. Bare i løpet av det siste året har forskere tatt spennende fremskritt mot å lære hvordan og hvor i hjernen ulike aspekter av minnene våre befinner seg. Mer overraskende har de til og med funnet biokjemiske mekanismer som skiller gode minner fra dårlige.
Fordi vi er skapninger med hjerner, tenker vi ofte på hukommelse i rent nevrologiske termer. Likevel antyder arbeid publisert tidlig i 2022 av forskere ved California Institute of Technology at selv individuelle celler i utviklende vev kan bære noen registreringer av deres avstamningshistorie. Disse stamcellene ser ut til å stole på den lagrede informasjonen når de står overfor beslutninger om hvordan de skal spesialisere seg som svar på kjemiske signaler. Fremskritt innen biologi det siste året avslørte også mange andre overraskelser, inkludert innsikt i hvordan hjernen tilpasser seg langvarig matmangel og hvordan migrerende celler følger en vei gjennom kroppen. Det er verdt å se tilbake på noe av det beste av det arbeidet før avsløringene av det kommende året gir oss et nytt perspektiv på oss selv igjen.
Introduksjon
Mange mennesker knyttet til Alzheimers sykdom, enten gjennom forskning eller gjennom personlige bånd til pasienter, håpet at 2022 skulle bli et bannerår. Store kliniske studier vil til slutt avsløre om to nye medisiner som adresserer den oppfattede grunnårsaken til sykdommen virket. Resultatene falt dessverre ikke til forventningene. Et av legemidlene, lecanemab, viste potensial for å bremse den kognitive nedgangen til noen pasienter, men var også knyttet til noen ganger dødelige bivirkninger; den andre, gantenerumab, ble ansett som en direkte fiasko.
De skuffende resultatene begrenser tre tiår med forskning basert sterkt på teorien om at Alzheimers sykdom er forårsaket av plakk av amyloidproteiner som bygger seg opp mellom hjerneceller og dreper dem. Montering av bevis tyder imidlertid på at amyloid bare er en komponent i en mye mer kompleks sykdomsprosess som involverer skadelig betennelse og funksjonsfeil i hvordan cellene resirkulerer proteinene sine. De fleste av disse ideene har eksistert like lenge som amyloidhypotesen, men begynner bare så vidt å få den oppmerksomheten de fortjener.
Faktisk begynner aggregeringer av proteiner rundt celler å se ut som en nesten universelt fenomen i aldrende vev og ikke en tilstand som er særegen for amyloid og Alzheimers sykdom, ifølge arbeid fra Stanford University-forskere som ble annonsert i et fortrykk i fjor vår. Observasjonen kan være enda et bevis på at forverrede problemer med proteinhåndtering kan være en rutinemessig konsekvens av aldring for celler.
Introduksjon
Nevrovitenskapsmenn har lenge forstått mye om hvordan minner dannes - i prinsippet. De har visst at når hjernen oppfatter, føler og tenker, styrker den nevrale aktiviteten som gir opphav til disse opplevelsene de synaptiske forbindelsene mellom de involverte nevronene. Disse varige endringene i nevrale kretsløp blir de fysiske registreringene av minnene våre, noe som gjør det mulig å gjenskape de elektriske mønstrene i opplevelsene våre når de trengs. De nøyaktige detaljene i denne prosessen har likevel vært kryptiske. Tidlig i år endret det seg da forskere ved University of South California beskrev en teknikk for visualisere disse endringene som de forekommer i en levende hjerne, som de pleide å se en fisk lære å assosiere ubehagelig varme med et lett signal. Til deres overraskelse, mens denne prosessen styrket noen synapser, slettet den andre.
Informasjonsinnholdet i et minne er bare en del av det hjernen lagrer. Minner er også kodet med en følelsesmessig "valens" som kategoriserer dem som en positiv eller negativ opplevelse. I fjor sommer rapporterte forskere at nivåer av et enkelt molekyl frigjort av nevroner, kalt neurotensin, ser ut til å fungere som flagg for den merkingen.
Introduksjon
Livet på jorden begynte med den første opptredenen av celler for omtrent 3.8 milliarder år siden. Men paradoksalt nok, før det fantes celler, må det ha vært samlinger av molekyler som gjorde overraskende naturtro ting. I løpet av det siste tiåret har forskere i Japan utført eksperimenter med RNA-molekyler for å finne ut om en enkelt type replikerende molekyl kan utvikle seg til en mengde forskjellige replikatorer, slik forskere på livets opprinnelse har teoretisert må ha skjedd i naturen. De japanske forskerne fant at denne diversifiseringen skjedde, med forskjellige molekyler som utviklet seg sammen til konkurrerende verter og parasitter som steg og falt i dominans. I mars i fjor rapporterte forskerne om en ny utvikling: De forskjellige molekylene hadde begynt å jobbe sammen i en mer stabilt økosystem. Arbeidet deres antyder at RNA og andre molekyler i den prebiotiske verden på samme måte kunne ha utviklet seg sammen for å legge grunnlaget for cellulært liv.
Selvreplikasjon blir ofte behandlet som det essensielle første trinnet i enhver hypotese om livets opprinnelse, men det trenger ikke å være det. I år fortsatte Nick Lane og andre evolusjonsbiologer å finne bevis på at før celler eksisterte, systemer for "proto-metabolisme" som involverer komplekse sett med energetiske reaksjoner, kan ha oppstått i de porøse materialene nær hydrotermiske ventiler.
Introduksjon
Hvordan vokser en enkelt befruktet eggcelle til en voksen menneskekropp med over 30 billioner celler i mer enn 200 spesialiserte kategorier? Det er det essensielle mysteriet med utvikling. I store deler av det siste århundret har den dominerende forklaringen vært at kjemiske gradienter etablert i ulike deler av den utviklende kroppen leder cellene dit de trengs og forteller dem hvordan de skal differensiere seg til bestanddeler av hud, muskler, bein, hjerne og andre organer.
Men kjemikalier ser nå ut til å være bare en del av svaret. Nyere arbeid tyder på at selv om celler bruker kjemiske gradient-ledetråder for å veilede navigasjonen, følger de også mønstre av fysisk spenning i vevet som omgir dem, som tightropers som krysser en stram kabel. Fysisk spenning gjør mer enn å fortelle cellene hvor de skal gå. Annet arbeid rapportert i mai viste at mekaniske krefter inne i et embryo også bidrar til å indusere sett med celler til å bli spesifikke strukturer, for eksempel fjær i stedet for hud.
I mellomtiden har syntetiske biologer - forskere som tar en ingeniørmessig tilnærming til studiet av liv - gjort viktige fremskritt i å forstå hvilke typer genetiske algoritmer som kontrollerer hvordan celler differensierer som svar på kjemiske signaler. Et team ved Caltech demonstrerte en kunstig nettverk av gener som stabilt kan transformere stamceller til en rekke mer spesialiserte celletyper. De har ikke identifisert hva det naturlige genetiske kontrollsystemet i celler er, men suksessen til modellen deres beviser at uansett hva det virkelige systemet er, trenger det sannsynligvis ikke å være mye mer komplisert.
Introduksjon
Hjernen er det mest energihungrige organet i kroppen, så det er kanskje ikke overraskende at evolusjonen utviklet en nødstrategi for å hjelpe hjernen med å takle lange perioder med matmangel. Forskere ved University of Edinburgh oppdaget at når mus må overleve på korte rasjoner i uker i strekk, begynner hjernen deres å operere tilsvarende "lav strøm"-modus.
I denne tilstanden bruker nevroner i den visuelle cortex nesten 30 % mindre energi på synapsene. Fra et teknisk synspunkt er det en fin løsning for å strekke hjernens energiressurser, men det er en hake. Faktisk reduserer laveffektmodus oppløsningen av dyrets syn ved å gjøre det visuelle systemets prosesssignaler mindre presise.
Et teknisk syn på hjernen forbedret også nylig vår forståelse av et annet sansesystem: luktesansen. Forskere har forsøkt å forbedre evnen til datastyrte "kunstige neser" til å gjenkjenne lukter. Kjemiske strukturer alene går langt mot å definere luktene vi forbinder med ulike molekyler. Men nytt arbeid tyder på at metabolske prosesser som skaper molekyler i naturen, reflekterer også vår sans for lukten av molekylene. Nevrale nettverk som inkluderte metabolsk informasjon i analysene deres kom betydelig nærmere å klassifisere lukter slik mennesker gjør.
Introduksjon
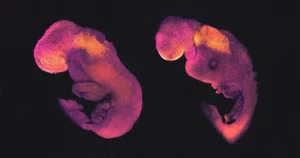
En levende menneskelig hjerne er fortsatt en vanvittig vanskelig ting for nevrovitenskapsmenn å studere: Hodeskallen hindrer utsikten deres og etiske hensyn utelukker mange potensielt informative eksperimenter. Det er derfor forskere har begynt å dyrke isolert hjernevev i laboratoriet og la det danne "organoider" med fysiske og elektriske likheter med ekte hjerner. I år viste nevrovitenskapsmannen Sergiu Paşca og hans kolleger hvor langt disse likhetene går ved å implantere menneskelige hjerneorganoider til nyfødte laboratorierotter. Menneskecellene integrerte seg i dyrets nevrale kretsløp og tok på seg en rolle i luktesansen. Dessuten så de transplanterte nevronene sunnere ut enn de som vokste i isolerte organoider, noe som tyder på, som Paşca bemerket i et intervju med Quanta, viktigheten av å gi nevroner innganger og utganger. Arbeidet viser veien mot å utvikle bedre eksperimentelle modeller for menneskelige hjerner i fremtiden.