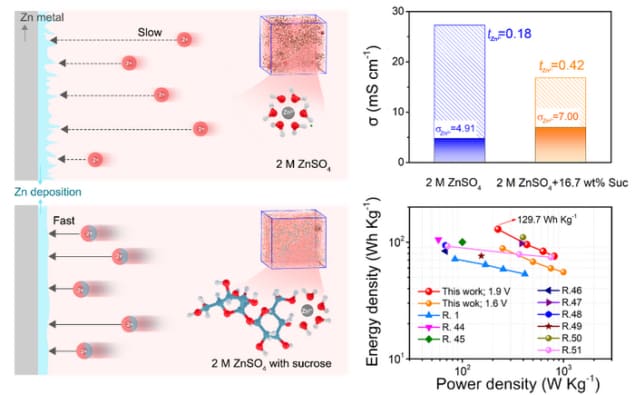
Wodne baterie cynkowe są obiecującą alternatywą dla swoich kuzynów litowo-jonowych, ale borykają się z jednym z tych samych problemów: tworzeniem się dendrytów. Te igiełkowate struktury tworzą się na powierzchni anody cynkowej i wrastają w elektrolit, powodując zwarcie akumulatora, a w niektórych przypadkach nawet jego zapłon. Zespół naukowców z Chin wykazał, że dodanie do elektrolitu zwykłego cukru stołowego (sacharozy) modyfikowanego chemicznie grupami hydroksylowymi może spowolnić wzrost dendrytów cynkowych poprzez zmianę środowiska rozpuszczalnika. Co więcej, sacharoza tworzy również powłokę ochronną na anodzie i spowalnia jej korozję.
Baterie litowo-jonowe są obecnie najczęściej stosowanymi bateriami w przenośnej elektronice i pojazdach elektrycznych, ale łatwopalne i toksyczne elektrolity organiczne, które zawierają, są powodem do niepokoju. Lit jest również drogi w porównaniu z innymi, bardziej powszechnymi metalami, a globalna podaż jest ofiarą różnych niepewności. Baterie cynkowe, które normalnie wytwarza się z wodnych elektrolitów, są atrakcyjnym substytutem, ponieważ cynk jest tańszy, mniej toksyczny, łatwiejszy do recyklingu i szerzej dostępny niż lit. Charakteryzują się również wysoką gęstością energii i wysoką pojemnością właściwą (820 mAh/g i 5 855 mAh/cm3) i korzystny potencjał redoks (-0.76 V w porównaniu ze standardową elektrodą wodorową) anody Zn.
Problem polega na tym, że gdy jon cynku (Zn2+) stężenie na powierzchni anody spada do zera, zaczynają na niej narastać dendryty. Obecność tych struktur powoduje pogorszenie wydajności elektrochemicznej baterii i może być niebezpieczna, jeśli nie jest kontrolowana.
Modyfikacja środowiska rozpuszczalnika
Ostatnie badania wykazały, że modyfikacja środowiska rozpuszczalnika (lub „struktury solwatacji”), na przykład poprzez wprowadzenie soli lub dodanie mniejszej liczby cząsteczek wody, może zwiększyć szybkość, z jaką Zn2+ Jony poruszają się w odpowiedzi na pole elektryczne, a zatem hamują wzrost dendrytów. Jednak takie korekty niestety zmniejszają przewodność jonową systemu baterii, co prowadzi do słabszej ogólnej wydajności.
W nowym badaniu naukowcy kierowani przez eksperta nanotechnologii Meinan Liu ukończenia Uniwersytet Nauki i Technologii Chin odkryli, że wprowadzenie sacharozy zawierającej grupy hydroksylowe jest skutecznym sposobem regulowania struktury solwatacyjnej Zn2+ jonów, co zwiększa prędkość, z jaką jony propagują bez zmniejszania przewodnictwa jonowego. Sacharoza może również stabilizować wodny elektrolit, jednocześnie absorbując na anodzie Zn, tworząc na niej warstwę ochronną. Mówią, że utrudnia to korozję elektrolitu na anodzie Zn.
„Sacharoza z grupami hydroksylowymi silnie oddziałuje z Zn2+ w porównaniu z cząsteczkami wody w elektrolicie” – wyjaśnia Liu. „Może zatem zastąpić niektóre cząsteczki wody i koordynować z Zn2+, regulując w ten sposób strukturę solwatacyjną jonów.”
Zmniejszone tworzenie dendrytów
„Zmodyfikowany Zn2+ struktura solwatacyjna ma istotny wpływ na kinetykę jonów, w tym na szybkość, z jaką dyfundują przez elektrolit” – mówi. Świat Fizyki. „Nasze wyniki eksperymentalne jasno pokazują, że liczba przenoszenia Zn2+ ilość jonów wzrasta wraz z wprowadzeniem sacharozy. Ta zwiększona mobilność jonów pomaga zmniejszyć tworzenie się dendrytów, jak wspomniano.”

Sól przemysłowa tworzy bezpieczniejszą i bardziej zrównoważoną baterię cynkową
Zdaniem naukowców ich technika może pomóc naukowcom w opracowaniu wysokowydajnych baterii Zn i przybliżyć bezpieczną, przyjazną dla środowiska baterię Zn do rzeczywistości.
Patrząc w przyszłość, Liu i koledzy twierdzą, że planują skupić się na opracowaniu elektrolitów o dobrej przewodności jonowej, które działają w niższych temperaturach. Szczegółowo opisują swoje obecne badanie w Badania nano.