Naukowcy z Duke University Medical Center opracowali system wykrywania wspomaganego komputerowo (CAD) oparty na głębokim uczeniu się, aby identyfikować trudne do wykrycia przerzuty do mózgu na obrazach MR. Algorytm wykazywał doskonałą czułość i specyficzność, przewyższając inne opracowywane systemy CAD. Narzędzie wykazuje potencjał umożliwiający wcześniejszą identyfikację pojawiających się przerzutów do mózgu, umożliwiając nakierowanie na nie radiochirurgii stereotaktycznej (SRS) przy ich pierwszym pojawieniu się, a w przypadku niektórych pacjentów zmniejszenie liczby wymaganych zabiegów.
SRS, która wykorzystuje precyzyjnie zogniskowane wiązki fotonów w celu dostarczenia wysokiej dawki promieniowania do celów w mózgu podczas jednej sesji radioterapii, ewoluuje w kierunku standardowego leczenia pacjentów z ograniczoną liczbą przerzutów do mózgu. Aby jednak celować w przerzut, należy go najpierw zidentyfikować na obrazie MR. Niestety, około 10% nie jest, 30% w przypadku osób o wielkości poniżej 3 mm, nawet po ocenie przez ekspertów neuroradiologów.
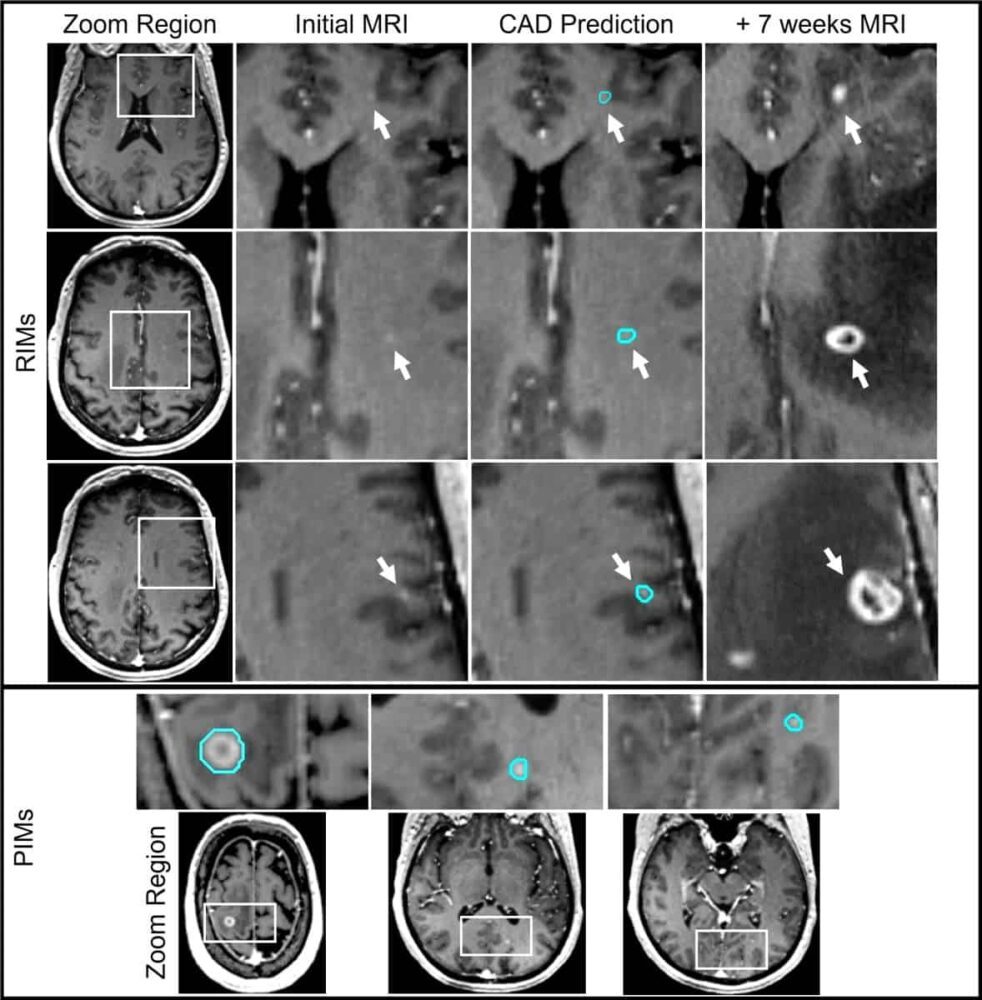
Kiedy te nieodkryte przerzuty do mózgu – które naukowcy określają jako retrospektywnie zidentyfikowane przerzuty (RIM) – zostaną zidentyfikowane na kolejnych skanach MRI, zwykle potrzebne jest drugie leczenie SRS. Takie leczenie jest drogie, może być niewygodne i inwazyjne, czasami wymaga unieruchomienia głowy za pomocą ramy przymocowanej do czaszki za pomocą szpilek.
Na ostatnim dorocznym spotkaniu ASTRO, Devona Godfreya wyjaśnił, że naukowcy zaprojektowali system CAD oparty na konwolucyjnej sieci neuronowej (CNN) specjalnie w celu poprawy wykrywania i segmentacji trudnych do wykrycia RIM i bardzo małych prospektywnie zidentyfikowanych przerzutów (PIM). Godfrey i współpracownicy opisują testowanie i walidację tego systemu w International Journal of Radiation Oncology Biology Physics.
Zespół przeszkolił narzędzie CAD na danych MRI (sekwencja zepsutego echa gradientowego ze wzmocnionym kontrastem) od 135 pacjentów z 563 przerzutami do mózgu. Obrazy zostały uzyskane przy użyciu skanerów MRI 1.5 T i 3.0 T od różnych dostawców w wielu lokalizacjach Duke Health. W sumie zbiór danych obejmował 491 PIM o medianie średnicy 6.7 mm i 72 RIM od 32 pacjentów o medianie średnicy 2.7 mm.
Aby zidentyfikować RIM, naukowcy przejrzeli oryginalne obrazy MR każdego pacjenta, aby wyszukać oznaki wzmocnienia kontrastowego dokładnie w miejscu, w którym później wykryto przerzuty. Po dokonaniu przeglądu sklasyfikowali każdy RIM jako spełniający kryteria diagnostyczne oparte na obrazowaniu (+DC) lub mający niewystarczające informacje wizualne (-DC), aby można je było zidentyfikować jako przerzut.
Naukowcy podzielili losowo zbiór danych RIM i PIM na pięć grup, z których cztery wykorzystali do opracowania modelu i algorytmu, a jedną jako grupę testową. „Włączenie zarówno RIM +DC, jak i -DC zaowocowało najwyższą czułością dla każdej kategorii i rozmiaru przerzutów do mózgu, przy jednoczesnym zwróceniu najniższego wskaźnika wyników fałszywie dodatnich i najwyższej pozytywnej wartości predykcyjnej” – donoszą. „To pokazuje wyraźną korzyść z włączenia przeważonego pobierania próbek małych, trudnych przerzutów do mózgu do danych treningowych CAD”.
W przypadku PIM i +DC RIM – które mają wyraźną charakterystykę przerzutów w MRI – model osiągnął ogólną czułość na poziomie 93%, w zakresie od 100% dla zmian o średnicy większej niż 6 mm do 79% dla zmian mniejszych niż 3 mm. Odsetek wyników fałszywie dodatnich był również imponująco niski, średnio 2.7 na osobę, w porównaniu z od ośmiu do 35 w innych systemach CAD o porównywalnej czułości wykrywania małych zmian.
System CAD był również w stanie wykryć niektóre obręcze -DC RIM zarówno w zestawie rozwojowym, jak i testowym. Identyfikacja przerzutów do mózgu na tym najwcześniejszym etapie byłaby wielką zaletą kliniczną, ponieważ takie zmiany mogłyby być następnie dokładniej monitorowane za pomocą obrazowania, co w razie potrzeby skłoniłoby do podjęcia leczenia.
Zespół Duke pracuje obecnie nad poprawą dokładności narzędzia CAD poprzez wykorzystanie wielu sekwencji MR. Godfrey wyjaśnia, że badania MRI mózgu prawie zawsze obejmują wiele sekwencji MR, które dostarczają unikalnych informacji o każdym wokselu w mózgu. „Uważamy, że włączenie dodatkowych informacji dostępnych z tych innych sekwencji powinno poprawić ich dokładność” – mówi.
Godfrey zauważa, że już tylko kilka tygodni dzieli naukowców od rozpoczęcia symulowanego prospektywnego badania klinicznego istniejącego systemu CAD w celu zbadania, w jaki sposób narzędzie wpływa na podejmowanie decyzji klinicznych zarówno przez radiologów, jak i radiologów onkologów.
Głębokie uczenie pomaga radiologom wykryć raka płuc na zdjęciu rentgenowskim klatki piersiowej
„Wielu ekspertów neuroradiologów i onkologów zajmujących się neuropromieniowaniem, którzy wykonują SRS, otrzyma skany MR mózgu. Zostaną poproszeni o znalezienie jakiejkolwiek zmiany, która może być przerzutem do mózgu, ocenę poziomu pewności, że tak jest, i stwierdzenie, czy leczą zmianę za pomocą SRS, w oparciu o jej pojawienie się na obrazach” – mówi. Świat Fizyki. „Następnie przedstawimy im prognozy CAD i ocenimy wpływ CAD na decyzje kliniczne każdego lekarza”.
Jeśli to badanie symulacyjne przyniesie obiecujące wyniki, Godfrey przewiduje wdrożenie narzędzia CAD do prospektywnej identyfikacji trudnych przerzutów do mózgu u nowych pacjentów leczonych w klinice Duke Radiation Oncology zgodnie z protokołem badawczym, być może już w połowie 2023 roku.