Urazowe uszkodzenie mózgu (TBI), spowodowane nagłym wstrząsem lub uderzeniem w głowę, wymaga jak najszybszej diagnozy. Aby zapobiec nieodwracalnym szkodom, krytyczne dla życia decyzje dotyczące leczenia należy podjąć w „złotej godzinie” po urazie. Diagnozowanie TBI w miejscu opieki jest jednak trudne, opiera się na obserwacjach dokonywanych przez załogę karetki pogotowia, a następnie po przybyciu do szpitala na badania radiologiczne, takie jak rezonans magnetyczny lub tomografia komputerowa.
Aby umożliwić szybszą interwencję, naukowcy z University of Birmingham opracowują ręczne urządzenie diagnostyczne, które wykrywa TBI poprzez świecenie bezpiecznego lasera w oko. Urządzenie opisane w Postępy naukijest przeznaczony do stosowania natychmiast po wystąpieniu urazu – na poboczu drogi, na polu bitwy czy na boisku – w celu oceny pacjentów pod kątem TBI, określenia ciężkości urazu i odpowiedniego leczenia.
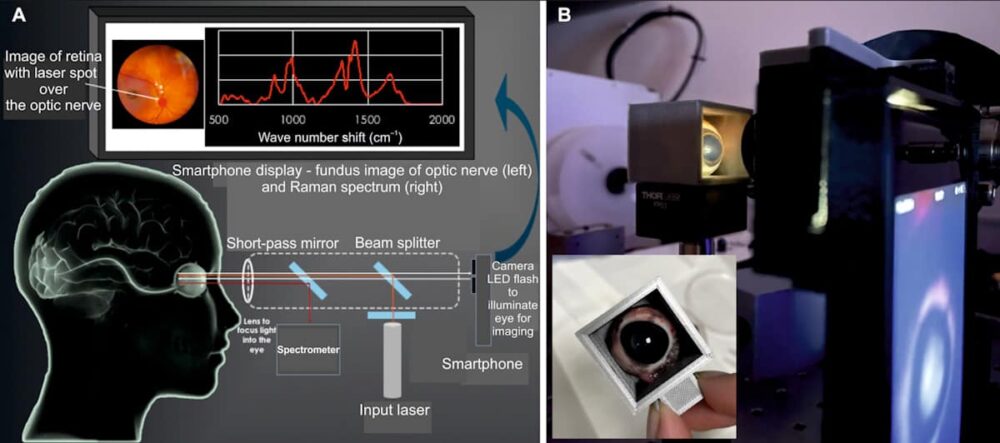
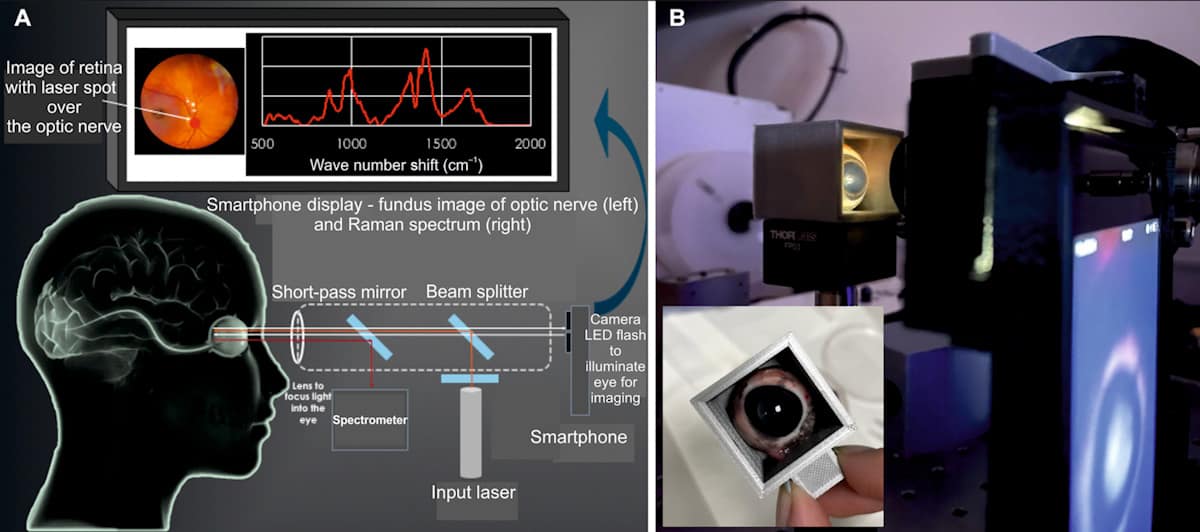
Bezpieczne dla oczu urządzenie (EyeD) opiera się na spektroskopii Ramana – technice optycznej, która wykorzystuje nieelastyczne rozpraszanie światła laserowego do badania składu molekularnego. Działa poprzez naświetlanie rogówki laserem klasy 635 o długości fali 1 nm. Skolimowana wiązka jest następnie skupiana na siatkówce za pomocą optyki oka. Aby skierować laser na żądany obszar, system EyeD jednocześnie wykonuje obrazowanie dna oka i analizę spektroskopową za pomocą aparatu w smartfonie w celu wizualizacji tylnej części oka.
Widma Ramana zebrane z siatkówki i nerwu wzrokowego analizuje się pod kątem obecności zmian biochemicznych specyficznych dla TBI, stosując algorytm sztucznej sieci neuronowej SKiNET jako narzędzie wspomagające podejmowanie decyzji. Ponieważ siatkówka i nerw wzrokowy są ściśle powiązane z mózgiem, zmiany w biomarkerach po urazie będą odzwierciedlać zmiany biochemiczne w mikrośrodowisku mózgu.
„Nasze urządzenie umożliwi wczesną diagnozę TBI poprzez bezpośrednią ocenę ostrych zmian w stanie zagrożenia w czasie rzeczywistym w żywej tkance neurosiatkówkowej/nerwa wzrokowego. Umożliwia nam bezpośrednie i nieinwazyjne badanie tkanki centralnego układu nerwowego” – wyjaśnia kierownik zespołu Poli Goldberg Oppenheimer. „Analiza neuroretiny jako projekcji ośrodkowego układu nerwowego zapewnia wgląd w biochemię mózgu”.
Badania spektroskopowe
Aby przetestować działanie swojego urządzenia do obrazowania, Oppenheimer i współpracownicy skonstruowali fantom tkankowy, który naśladuje fizyczne wymiary i właściwości optyczne oka, zapewniając jednocześnie realistyczną sygnaturę ramanowską siatkówki. Fantom zawiera soczewkę, dziurkę o średnicy 4 mm reprezentującą nierozszerzoną źrenicę i uchwyt na próbkę tkanki siatkówki.
Zespół wykazał, że urządzenie EyeD może skutecznie skupiać wiązkę lasera w żądanym miejscu siatkówki. Widma zmierzone z fantomu tkankowego pozwoliły rozróżnić główne pasma Ramana w obszarze o wyższej liczbie falowej, co można wykorzystać do rozróżnienia wielu typów tkanek.
Następnie naukowcy wykorzystali prototypowe urządzenie do analizy próbek siatkówki oczu świń, które są podobne do oczu ludzkich pod względem wielkości, struktury, rozwoju i składu. Zebrali 510 pomiarów z 39 próbek siatkówki TBI i 12 próbek kontrolnych, rejestrując widma znajdujące się blisko tarczy nerwu wzrokowego. Ogólnie widma Ramana wykazały kilka charakterystycznych pasm w zakresie 1200–1700 cm--1 obszaru odcisków palców oraz wzmocnienie pasm o wysokiej liczbie falowej w zakresie 2800–3200 cm--1 region.
Wykorzystanie SKiNET do stworzenia samooptymalizujących się map (SOM) pokazujących grupowanie widm Ramana siatkówki ujawniło wyraźną separację między siatkówkami z TBI i próbkami kontrolnymi. Dzieje się tak, ponieważ widma Ramana odzwierciedlają zmiany biochemiczne w oku po TBI. Na przykład TBI zwiększa zawartość lipidów i białek w oku, powodując, że pochodzące z nich piki stają się bardziej wyraźne w widmach Ramana.
Najbardziej znaczące zmiany widmowe w odpowiedzi na TBI wynikały z udziału lipidów mózgowych, kardiolipiny i cytochromu C, co objawiało się wzrostem stosunku 2930 do 2850 cm--1 szczyt w widmie Ramana. Naukowcy wykorzystali wybrane cechy stosunku pików 2850/2930 i intensywności sześciu charakterystycznych pików z widm TBI, aby utworzyć klasyfikację SKiNET, uzyskując spektroskopowy kod kreskowy do wykrywania TBI.
Aby ocenić zdolność systemu EyeD do różnicowania TBI na podstawie zmian w siatkówce, obliczono pole pod krzywą (AUC) dla każdego piku oraz stosunek wartości szczytowych 2930/2850, a następnie wykreślono współczynniki wyników prawdziwie dodatnich i fałszywie ujemnych. Zastosowanie optymalizacji SKiNET z 10-krotną walidacją krzyżową danych szkoleniowych dało dokładność klasyfikacji na poziomie 90.7 ± 0.9%. Wynik ten wskazuje, że zmiany w stosunku szczytowym 2930/2850 po TBI mogą stanowić cenny wskaźnik umożliwiający odróżnienie TBI od zdrowych kontroli.
„Wykorzystanie jednoczesnej spektroskopii Ramana i obrazowania dna oka, w formie niedrogiego, podręcznego urządzenia, stanowi pierwszą namacalną drogę do nieinwazyjnej diagnostyki TBI w miejscu opieki” – mówi Oppenheimer Świat Fizyki.

W przypadku wstrząsu mózgu oczy są zwierciadłem mózgu
Kolejnym krokiem będzie optymalizacja prototypu pod kątem walidacji klinicznej. Aby ułatwić tłumaczenie kliniczne, badacze planują zastąpić samodzielny spektrometr kompaktowym spektrometrem instalowanym na urządzeniu i odczytem na smartfonie, umożliwiając fotografowanie dna oka i spektroskopię Ramana na jednym ekranie smartfona.
„Obecnie pracujemy nad przyjaznym dla użytkownika urządzeniem do wdrożenia, zintegrowanym z algorytmem naszej sztucznej sieci neuronowej w celu automatycznej interpretacji wyników bez konieczności korzystania ze specjalistycznego wsparcia i szybkiej klasyfikacji danych widmowych” – mówi Oppenheimer. „[Przeprowadzamy także] ocenę kliniczną użyteczności urządzenia u zdrowych ochotników i pacjentów, aby wykazać jego potencjał w zakresie diagnozy w czasie rzeczywistym. Po ustaleniu tolerancji i użyteczności urządzenia przystępujemy do pierwszej oceny na ludziach i badania klinicznego na małą skalę”.
- Dystrybucja treści i PR oparta na SEO. Uzyskaj wzmocnienie już dziś.
- PlatoData.Network Pionowe generatywne AI. Wzmocnij się. Dostęp tutaj.
- PlatoAiStream. Inteligencja Web3. Wiedza wzmocniona. Dostęp tutaj.
- PlatonESG. Węgiel Czysta technologia, Energia, Środowisko, Słoneczny, Gospodarowanie odpadami. Dostęp tutaj.
- Platon Zdrowie. Inteligencja w zakresie biotechnologii i badań klinicznych. Dostęp tutaj.
- Źródło: https://physicsworld.com/a/handheld-device-uses-eye-safe-retinal-spectroscopy-to-diagnose-brain-injury/
- :Jest
- 1
- 10
- 12
- 39
- a
- zdolność
- AC
- odpowiednio
- precyzja
- nabycie
- dodatek
- Po
- przed
- algorytm
- dopuszczać
- Pozwalać
- również
- amerykański
- an
- analizować
- analiza
- i
- Zastosowanie
- SĄ
- POWIERZCHNIA
- na około
- przylot
- sztuczny
- AS
- oszacować
- oceniając
- At
- Auc
- zautomatyzowane
- z powrotem
- na podstawie
- Battlefield
- BE
- Belka
- bo
- stają się
- pomiędzy
- Mózg
- by
- obliczony
- aparat fotograficzny
- CAN
- powodowany
- spowodowanie
- centralny
- Zmiany
- charakterystyka
- Charakterystyka
- klasa
- klasyfikacja
- jasny
- kliknij
- Kliniczne
- Zamknij
- dokładnie
- klastrowanie
- koledzy
- kompaktowy
- skład
- pojęcie
- Warunki
- zawartość
- składki
- kontrola
- kontroli
- mógłby
- Stwórz
- Obecnie
- krzywa
- uszkodzić
- dane
- decyzja
- Decyzje
- wykazać
- wykazać
- opisane
- Wnętrze
- życzenia
- Wykrywanie
- Ustalać
- rozwijanie
- oprogramowania
- urządzenie
- diagnozowanie
- diagnoza
- diagnostyczny
- diagnostyka
- różnicować
- trudny
- Wymiary
- kierować
- bezpośrednio
- rozróżniać
- nieszczęście
- z powodu
- każdy
- łatwość
- faktycznie
- umożliwiać
- Umożliwia
- umożliwiając
- Inżynieria
- ustanowienie
- oceny
- ewaluację
- przykład
- Objaśnia
- oko
- Oczy
- Korzyści
- odcisk palca
- i terminów, a
- Skupiać
- koncentruje
- następnie
- następujący
- piłka nożna
- W razie zamówieenia projektu
- Nasz formularz
- od
- głowa
- zdrowy
- posiadacz
- szpital
- Jednak
- HTTPS
- człowiek
- obraz
- Obrazowanie
- Rezultat
- in
- obejmuje
- Zwiększać
- Zwiększenia
- wskazuje
- Wskaźnik
- Informacja
- szkoda
- zintegrowany
- interpretacja
- interwencja
- najnowszych
- Dochodzenia
- problem
- IT
- JEGO
- jpg
- laser
- lider
- lekki
- powiązany
- życie
- low-cost
- zrobiony
- poważny
- Mapy
- Maksymalna szerokość
- Pomiary
- Cząsteczkowa
- jeszcze
- większość
- MRI
- wielość
- musi
- sieć
- nerwowy
- sieci neuronowe
- Następny
- numer
- of
- Oferty
- on
- na
- koncepcja
- optyka
- optymalizacja
- Optymalizacja
- or
- pochodzący
- ludzkiej,
- Wyjścia
- ogólny
- własny
- pakowane
- ścieżka
- pacjenci
- Szczyt
- jest gwarancją najlepszej jakości, które mogą dostarczyć Ci Twoje monitory,
- wykonuje
- fantom
- fotografia
- fizyczny
- Fizyka
- Świat Fizyki
- Smoła
- krok po kroku
- plato
- Analiza danych Platona
- PlatoDane
- plus
- przenośny
- position
- możliwy
- potencjał
- obecność
- zapobiec
- sonda
- Projekcja
- wyraźny
- niska zabudowa
- Białko
- prototyp
- zapewniać
- zapewnia
- że
- szybko
- szybko
- ceny
- stosunek
- real
- w czasie rzeczywistym
- realistyczny
- nagranie
- odzwierciedlić
- region
- opierając się
- obsługi produkcji rolnej, która zastąpiła
- reprezentowanie
- Wymaga
- Badacze
- zdecydowany
- odpowiedź
- dalsze
- siatkówka
- Ujawnił
- "bezpiecznym"
- mówią
- nauka
- Ekran
- wybrany
- kilka
- pokazał
- podpis
- znaczący
- podobny
- jednocześnie
- pojedynczy
- SIX
- Rozmiar
- smartphone
- So
- wkrótce
- specjalista
- Widmowy
- Spektroskopia
- SPORTOWE
- standalone
- Ewolucja krok po kroku
- Struktura
- taki
- nagły
- wsparcie
- system
- namacalny
- cel
- ukierunkowane
- zespół
- technika
- Technologia
- test
- że
- Połączenia
- Strefa
- ich
- następnie
- Te
- one
- to
- Przez
- miniatur
- czas
- aktualny
- do
- narzędzie
- w kierunku
- Trening
- Tłumaczenie
- leczenie
- próba
- prawdziwy
- typy
- dla
- na
- us
- użyteczność
- posługiwać się
- używany
- łatwy w obsłudze
- zastosowania
- za pomocą
- uprawomocnienie
- Cenny
- przez
- wyobrażać sobie
- wolontariuszy
- we
- były
- czy
- który
- Podczas
- będzie
- okno
- okna
- w
- w ciągu
- bez
- działa
- świat
- wydajność
- zefirnet