Guzy można zniszczyć na wiele sposobów. Radioterapia wykorzystuje wiązki promieniowania jonizującego do uszkodzenia DNA i zniszczenia komórek nowotworowych. Mniej powszechnym podejściem jest terapia fotodynamiczna, która wykorzystuje lek aktywowany światłem do zabijania komórek nowotworowych poprzez uszkodzenie mitochondriów. Następnie pojawia się nowa technika terapii radiodynamicznej (RDT).
„Terapia radiodynamiczna to połączenie radioterapii i terapii fotodynamicznej” – wyjaśnił Charlie Mam z Fox Chase Cancer Center, przemawiający podczas niedawnego wystąpienia Doroczne spotkanie AAPM.
Terapia fotodynamiczna zazwyczaj wykorzystuje widzialne światło lasera do aktywacji światłoczułego leku, który jest preferencyjnie zlokalizowany w komórkach nowotworowych. Aktywowany lek wytwarza wysoce cytotoksyczny tlen singletowy, który powoduje śmierć komórki. Ograniczona penetracja światła lasera do tkanki oznacza jednak, że technikę tę stosuje się głównie w leczeniu powierzchownych guzów lub miejsc, do których dostęp endoskopowy jest możliwy. W leczeniu nowotworów głęboko osadzonych, do których nie dociera terapia fotodynamiczna, RDT wykorzystuje wysokoenergetyczne wiązki fotonów w celu aktywacji fotosensybilizatora.
„W RDT wykorzystujemy od 20 do 30 procent dawki radioterapii” – wyjaśniła Ma. „A potem używamy również światła Czerenkowa”. Zauważył, że to promieniowanie Czerenkowa, które powstaje podczas radioterapii w wyniku oddziaływania wiązki leczniczej z tkanką pacjenta, będzie miało niemal identyczny rozkład światła jak rozkład dawki promieniowania terapeutycznego, a zatem będzie można je łatwo zaplanować.
Oprócz gromadzenia się w guzie pierwotnym lek będzie także wchłaniany przez rozproszone komórki przerzutowe, które można zabić przy użyciu bardzo małej dawki światła Czerenkowa. „Teraz po raz pierwszy RDT czyni radioterapię nie tylko lokalną i regionalną, ale także techniką leczenia systemowego” – powiedziała Ma.
Zespół Fox Chase używa leku o nazwie kwas 5-aminolewulinowy (5-ALA) w leczeniu RDT. 5-ALA jest wychwytywany przez mitochondria w komórkach nowotworowych, z 10 do 20 razy większym wychwytem w nowotworach niż w normalnych tkankach. Po wejściu do komórki nowotworowej 5-ALA jest metabolizowany do protoporfiryny IX (PpIX), fotouczulacza o piku widma absorpcji przy około 380–430 nm. Nie jest to idealne rozwiązanie w przypadku czerwonego światła lasera często używanego w terapii fotodynamicznej. Jednakże doskonale pasuje do piku absorpcji Czerenkowa przy 370–430 nm.
Dowód przedkliniczny
W ciągu ostatnich kilku lat Ma i jego zespół przeprowadzili wiele badań przedklinicznych, wykorzystując różne linie komórek nowotworowych i różne energie promieniowania. Podzielił się niektórymi wynikami dużego badania (kilkaset zwierząt), w którym oceniano RDT myszy z nowotworem przy użyciu 100 mg/kg 5-ALA i napromieniania fotonami o energii 6, 15 lub 45 MV.
Ma zauważyła, że guz był bardzo agresywny, a sama radioterapia w dawce 4 Gy zabiła jedynie około 10% komórek nowotworowych. Ponadto RDT przy 6 MV nie zwiększyło znacząco efektu terapeutycznego. „Dlatego ludzie martwili się, że światło Czerenkowa nie wystarczy” – zauważył. „Ale przy 15 i 45 MV widać znacznie większe opóźnienie wzrostu guza. Wciąż badamy, dlaczego następuje tak dramatyczna zmiana pod wpływem energii. Musimy znaleźć dokładny mechanizm, który za tym stoi”.
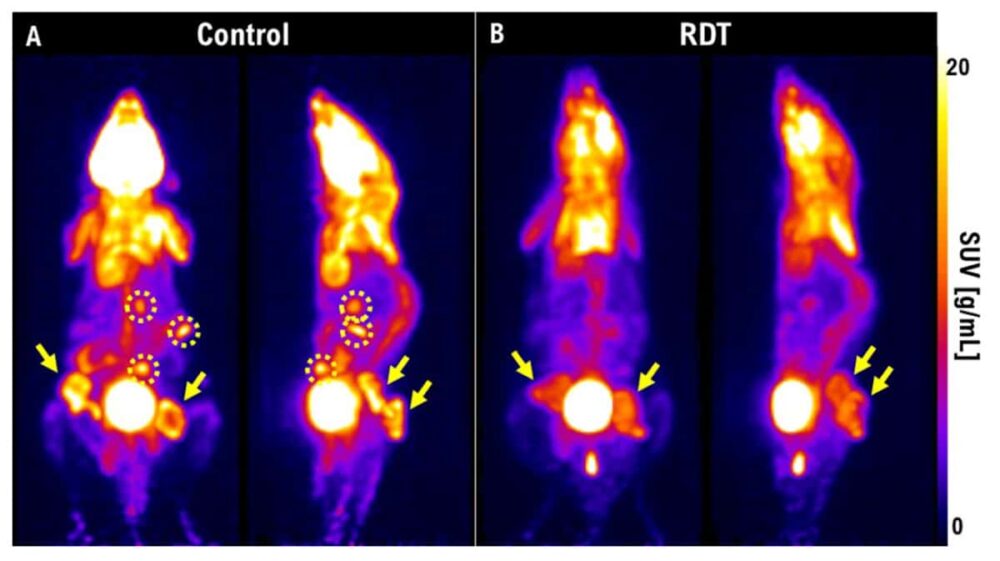
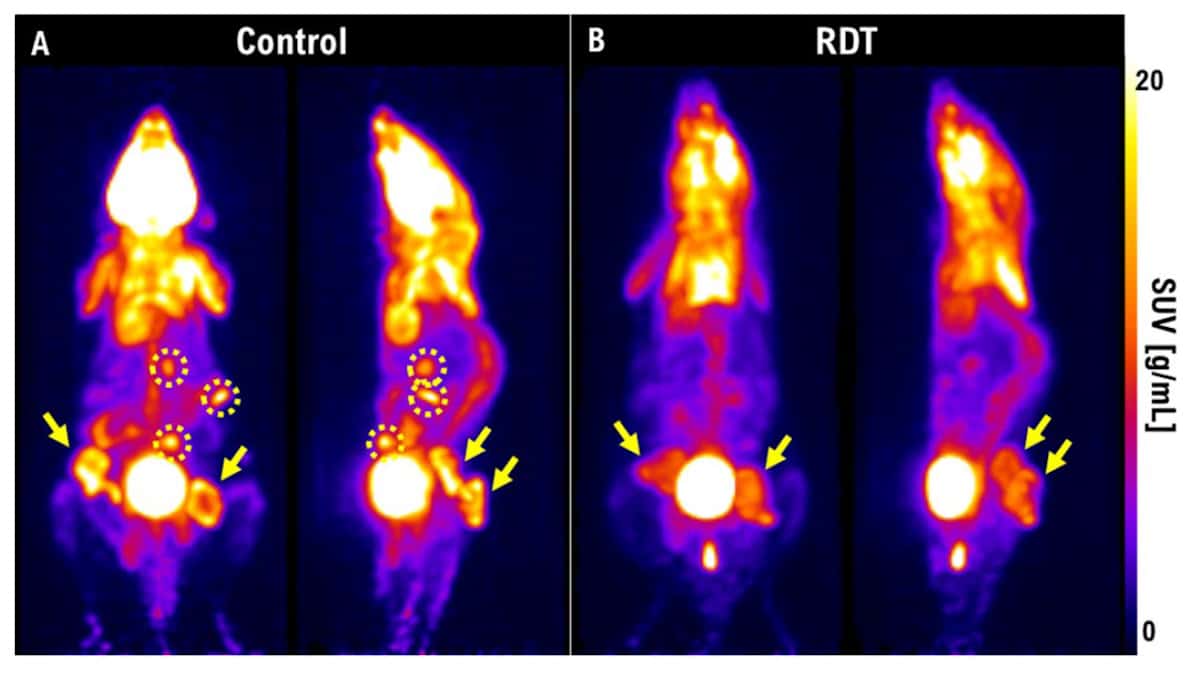
Zespół wykorzystał PET do wizualizacji kurczenia się guza po RDT. Tydzień po leczeniu guzy u myszy kontrolnych urosły i dały przerzuty, podczas gdy u myszy leczonych RDT miały znacznie mniejsze zmiany i żadnych przerzutów. Ma opisał także badanie dotyczące bardzo agresywnego raka tarczycy u królików. Tydzień po radioterapii w dawce 3 Gy guz nadal rósł. „Ale jeśli zastosujemy RDT przy dawce 3 Gy i 5-ALA, guza nie będzie widać na obrazach PET”. Podkreślił, że PET stanowi doskonały sposób na wczesną ocenę leczenia i może pomóc w ustaleniu, czy RDT będzie skuteczna u pacjenta.
Fox Chase prowadzi obecnie badanie kliniczne RDT, którego pierwsza faza dotyczy zwiększania dawki (zarówno dawki promieniowania, jak i dawki leku) w późnych stadiach nowotworów. Ta faza osiągnęła już poziom dawki końcowej, pozostało już tylko trzech pacjentów, stwierdziła Ma, podkreślając, że jak dotąd w żadnym przypadku nie wystąpiły żadne działania toksyczne. W innym miejscu drugie badanie RDT w Szpitalu Uniwersyteckim w Muenster bada pacjentów z pierwszym nawrotem glejaka wielopostaciowego.
Przypadki z życia wzięte
Na koniec Ma przedstawił wyniki szeregu rzeczywistych przypadków. „Będziecie podekscytowani, widząc to” – powiedział publiczności, zauważając, że „zwykle ludzie nie wierzą, że to działa, jeśli nie robi się przez miesiąc obrazowania za pomocą tomografii komputerowej, rezonansu magnetycznego lub PET”.
W pierwszym przykładzie dotyczącym leczenia przerzutów do wątroby wykazał, że miesiąc po RDT obrazowanie PET wykazało, że nie pozostał żaden guz. Następnie przedstawił przypadek raka płuc z przerzutami: „można zobaczyć bardzo dramatyczne wyniki w przypadku dezaktywacji guzów po RDT” – powiedział.
Wszczepialne urządzenie zapewnia spersonalizowaną terapię fotodynamiczną
Inne skuteczne metody leczenia RDT obejmowały raka przełyku, guza płuc z licznymi przerzutami do kości oraz pacjenta, u którego nie powiodła się chemioterapia, ale uzyskano dobrą odpowiedź trzy dni po RDT. Ma zauważyła, że większość pacjentów miała nowotwór w późnym stadium i inne metody leczenia zawiodły. „Widzimy efekty, więc miejmy nadzieję, że uda nam się poprawić ich przeżywalność” – dodał.
„RDT może być leczeniem lokalnym, regionalnym i systemowym, łączącym radioterapię i terapię fotodynamiczną” – podsumowała Ma. „Mamy dużo in vitro i in vivo eksperymenty mające na celu wykazanie jego potencjału terapeutycznego i chociaż badań klinicznych jest niewiele, mam nadzieję, że w przyszłości uzyskamy więcej wyników i zamienimy je w coś naprawdę przydatnego”.
- Dystrybucja treści i PR oparta na SEO. Uzyskaj wzmocnienie już dziś.
- PlatoData.Network Pionowe generatywne AI. Wzmocnij się. Dostęp tutaj.
- PlatoAiStream. Inteligencja Web3. Wiedza wzmocniona. Dostęp tutaj.
- PlatonESG. Motoryzacja / pojazdy elektryczne, Węgiel Czysta technologia, Energia, Środowisko, Słoneczny, Gospodarowanie odpadami. Dostęp tutaj.
- Przesunięcia bloków. Modernizacja własności offsetu środowiskowego. Dostęp tutaj.
- Źródło: https://physicsworld.com/a/radiodynamic-therapy-harnessing-light-to-improve-cancer-treatments/
- :ma
- :Jest
- :nie
- $W GÓRĘ
- 10
- 100
- 15%
- 20
- 30
- a
- O nas
- dostęp
- w dodatku
- dodatek
- Po
- agresywny
- AL
- sam
- również
- Chociaż
- an
- i
- zwierzęta
- roczny
- każdy
- podejście
- SĄ
- na około
- AS
- oceniając
- At
- publiczność
- BE
- Belka
- za
- uwierzyć
- KOŚĆ
- obie
- ale
- by
- nazywa
- CAN
- Rak
- Komórki nowotworowe
- nie może
- walizka
- Etui
- Przyczyny
- Komórki
- Centrum
- zmiana
- pościg
- koła
- kliknij
- Kliniczne
- Badania kliniczne
- połączenie
- kombajny
- wspólny
- zawarta
- kontrola
- mógłby
- Dni
- Śmierć
- opóźnienie
- dostarcza
- wykazać
- opisane
- zniszczyć
- zniszczony
- Ustalać
- urządzenie
- ZROBIŁ
- różne
- dystrybuowane
- 分配
- DNA
- do
- nie
- dramatycznie
- lek
- z powodu
- podczas
- Wcześnie
- z łatwością
- efekt
- Efektywne
- gdzie indziej
- wschodzących
- podkreślił
- energia
- eskalacja
- ewaluację
- Badanie
- przykład
- doskonała
- podniecony
- eksperymenty
- wyjaśnione
- Failed
- daleko
- kilka
- finał
- Znajdź
- i terminów, a
- pierwszy raz
- następujący
- W razie zamówieenia projektu
- lis
- od
- przyszłość
- wygenerowane
- generuje
- dobry
- wspaniały
- większy
- Rozwój
- dorosły
- Wzrost
- miał
- Wykorzystywanie
- Have
- he
- pomoc
- wysoko
- jego
- nadzieję
- Ufnie
- Jednak
- HTTPS
- cetnar
- i
- idealny
- identiques
- if
- obraz
- zdjęcia
- Obrazowanie
- podnieść
- in
- włączony
- Zwiększać
- wskazać
- Informacja
- wewnątrz
- współdziała
- najnowszych
- problem
- IT
- JEGO
- jpg
- właśnie
- Zabić
- duży
- laser
- Nazwisko
- lewo
- mniej
- poziom
- lekki
- Ograniczony
- linie
- Wątroba
- miejscowy
- Partia
- niski
- głównie
- robić
- WYKONUJE
- wiele
- Mecz
- Maksymalna szerokość
- znaczy
- mechanizm
- mitochondria
- Miesiąc
- jeszcze
- większość
- mr
- dużo
- wielokrotność
- Potrzebować
- Następny
- Nie
- normalna
- zauważyć
- Zauważając
- już dziś
- numer
- miejsce
- of
- często
- on
- pewnego razu
- ONE
- tylko
- koncepcja
- or
- Inne
- na zewnątrz
- Tlen
- pacjent
- pacjenci
- Szczyt
- penetracja
- Ludzie
- dla
- wykonać
- wykonywane
- wykonywania
- Personalizowany
- faza
- Fizyka
- Świat Fizyki
- planowany
- plato
- Analiza danych Platona
- PlatoDane
- plus
- potencjał
- przedstawione
- pierwotny
- zapewnia
- Radioterapia
- dosięgnąć
- osiągnięty
- naprawdę
- niedawny
- nawrót
- Czerwony
- regionalny
- pozostał
- odpowiedź
- Efekt
- Ujawnił
- Powiedział
- druga
- widzieć
- widziany
- kilka
- shared
- pokazał
- znacznie
- Witryny
- mniejszy
- So
- dotychczas
- kilka
- coś
- Mówiąc
- Widmo
- Nadal
- badania naukowe
- Badanie
- Studiowanie
- udany
- wystarczający
- przetrwanie
- systemowy
- Zadania
- zespół
- niż
- że
- Połączenia
- Przyszłość
- ich
- następnie
- Tam.
- Te
- to
- tych
- trzy
- miniatur
- A zatem
- czas
- czasy
- do
- leczyć
- leczenie
- próba
- Próby
- prawdziwy
- zazwyczaj
- uniwersytet
- posługiwać się
- używany
- zastosowania
- za pomocą
- różnorodny
- początku.
- przez
- widoczny
- była
- Droga..
- sposoby
- we
- tydzień
- czy
- który
- Podczas
- dlaczego
- będzie
- w
- w ciągu
- działa
- świat
- zmartwiony
- by
- lat
- You
- zefirnet