Molekularna maszyneria naszego organizmu załamuje się wraz z wiekiem.
DNA gromadzi mutacje. Ich ochronne końce ulegają erozji. Mitochondria, fabryka energii komórki, słabną i psują się. Układ odpornościowy wariuje. Rezerwowa pula komórek macierzystych kurczy się, podczas gdy niektóre dojrzałe komórki wchodzą w stan przypominający zombie, wypluwając toksyczne chemikalia do swojego środowiska.
Obraz brzmi tragicznie, ale to nie wszystkie złe wieści. Starzenie się to skomplikowana zagadka. Odnajdując poszczególne elementy, naukowcy mogą zebrać pełny obraz tego, jak i dlaczego się starzejemy – i opracować nowe sposoby zapobiegania objawom związanym z wiekiem.
Odniósł już pewien sukces. Senolityki — leki zabijające komórki zombie —są już w fazie badań klinicznych. Częściowe przeprogramowanie, który usuwa tożsamość komórki i przywraca ją z powrotem do stanu przypominającego komórki macierzyste, zyskuje na popularności jako obiecująca alternatywna terapia i jest jedną z najgorętszych inwestycji w długowieczność w Dolinie Krzemowej.
Nowe badania in Natura wytropił kolejny element starzejącej się układanki. W przypadku pięciu gatunków w całej skali ewolucyjnej — robaków, much, myszy, szczurów i ludzi — zespół udoskonalił krytyczny proces molekularny, który zasila każdą pojedynczą komórkę w ciele i degraduje się wraz z wiekiem.
Proces, zwany transkrypcją, jest pierwszym krokiem w przekształcaniu naszego materiału genetycznego w białka. Tutaj litery DNA są przekształcane w „posłańca” zwanego RNA, który następnie przekazuje informacje do innych części komórki w celu wytworzenia białek.
Naukowcy od dawna podejrzewali, że transkrypcja może się nie udać wraz z wiekiem, ale nowe badanie dostarcza dowodów, że tak nie jest – z niespodzianką. U wszystkich pięciu badanych gatunków wraz ze starzeniem się organizmu proces ten nieoczekiwanie przyspieszył. Ale podobnie jak próba szybszego pisania z zasłoniętymi oczami, wskaźniki błędów również wzrosły.
Jest poprawka. Wykorzystując dwie interwencje, o których wiadomo, że wydłużają życie, zespół był w stanie spowolnić transkrypcję u wielu gatunków, w tym u myszy. Mutacje genetyczne, które odwróciły niechlujną transkrypcję, wydłużyły również żywotność robaków i muszek owocowych oraz zwiększyły zdolność ludzkich komórek do dzielenia się i wzrostu.
Nowa cecha starzenia się nie jest gotowa do testów na ludziach. Ale „otwiera naprawdę fundamentalny nowy obszar zrozumienia, jak i dlaczego się starzejemy” powiedziany Dr Lindsay Wu z UNSW Sydney, która nie brała udziału w badaniu.
Edytor genetyczny
Przekształcenie naszego planu genetycznego w białka to proces dwuetapowy.
Po pierwsze, cztery litery DNA — A, T, C i G — są przepisywane na RNA. Również składający się z czterech liter, RNA to w zasadzie notatki molekularne, które mogą prześlizgnąć się przez ograniczoną przestrzeń DNA, aby dostarczyć wiadomości do fabryki białek w komórce. Tam RNA jest tłumaczone na język białek.
Pierwszy krok — przekształcenie DNA w RNA — jest trudniejszy niż się wydaje. Aby zaoszczędzić miejsce, DNA jest ciasno owinięte wokół grupy białek zwanych histonami, jak bekon wokół ośmiu łodyg szparagów. To skutecznie „ukrywa” informację genetyczną, uniemożliwiając komórce odczytanie.
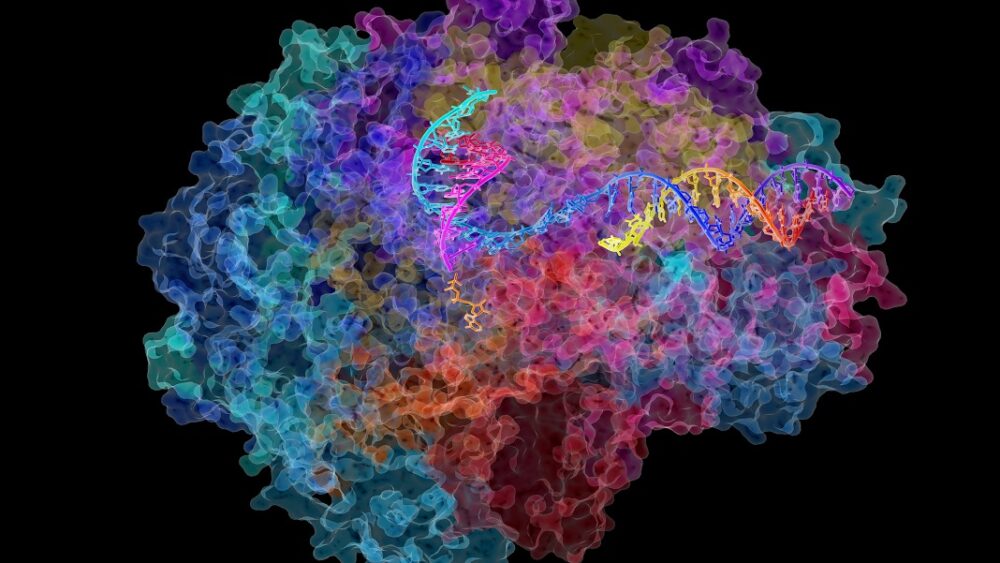
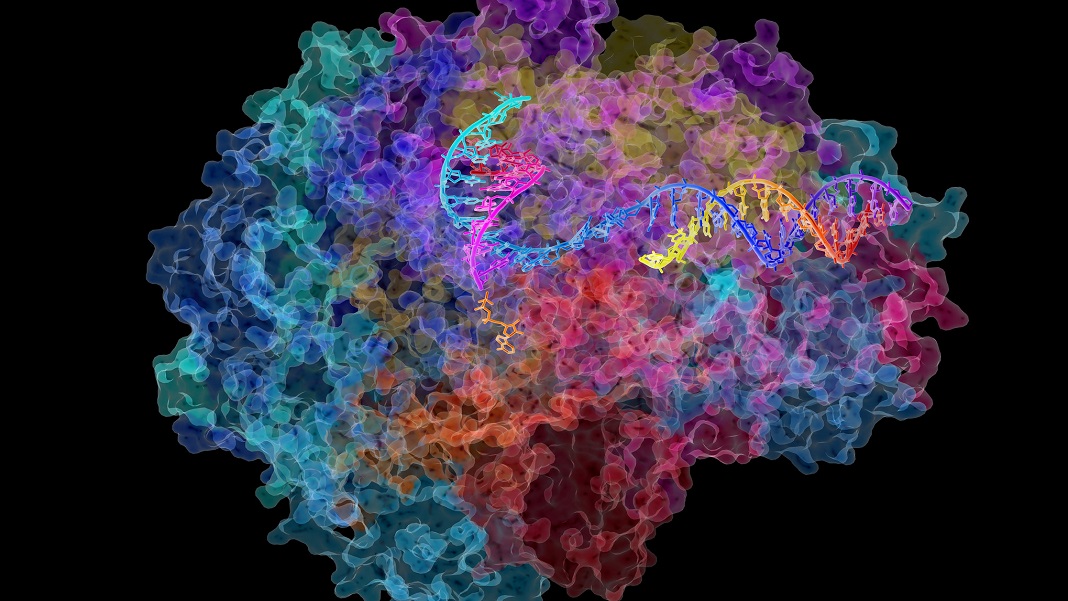
Potrzeba całej wioski białkowych pomocników, aby rozwinąć DNA i przygotować je do transkrypcji. Ale gwiazdą jest Pol II (polimeraza RNA II), gigantyczny multikompleks, który porusza się wzdłuż nici DNA, pomagając mu przekształcić się we wczesną wersję RNA, trafnie zwaną pre-RNA.
Podobnie jak rozwlekłe zdanie, pre-RNA jest następnie redagowane w bardziej zwięzłe sekwencje do budowy białek, proces zwany splicingiem. Pol II czuwa nad całym procesem, pilnując, aby setki tysięcy RNA były wykonane perfekcyjnie.
Jednak wraz z wiekiem proces ten ulega degradacji. Nikt nie domyślił się dlaczego.
W nowym badaniu zadano pytanie: dlaczego nie skupić się na gwieździe programu transkrypcji?
Gatunki obejmujące
Rozszyfrowanie oznak starzenia wiąże się z przeszkodą: potencjalny trop może dotyczyć tylko jednego gatunku.
Nowe badanie rozwiązało problem bezpośrednio, badając pięć gatunków. Wykorzystując technikę zwaną sekwencjonowaniem RNA, uchwycili prędkość Pol II, gdy przesuwał DNA robaka, muszki owocowej, myszy, szczura i komórek ludzkich w różnym wieku. Próbki ludzkie były w wieku od 21 do 70 lat, wraz z dwiema „nieśmiertelnymi” hodowanymi liniami komórkowymi.
Aby uzyskać jeszcze pełniejszy obraz, zespół przetestował próbki z wielu narządów, w tym mózgu, wątroby, nerek i krwi.
Wyniki wróciły jako niespodzianka. Chociaż każdy gatunek miał swoją własną „sygnaturę prędkości Pol II”, trend był taki sam: sonda II przyspieszała wśród gatunków wraz z wiekiem w każdej badanej tkance. Dokładny gen lub tkanka nie miały znaczenia. Zmiana związana z wiekiem objęła około 200 różnych genów u wielu gatunków. Bardziej niż lokalna zmiana, przyspieszenie Pol II wydawało się być uniwersalnym wyznacznikiem starzenia się.
Jednak wraz z szybkością pojawiły się błędy. Splicing – który edytuje pre-RNA – wymaga, aby prędkość Pol II znajdowała się w strefie Złotowłosej. Zwiększenie prędkości zwiększa ryzyko złych tłumaczeń, co w poprzednich badaniach „było związane z zaawansowanym wiekiem i krótszą długością życia” – wyjaśnili autorzy.
„Zwiększone prędkości Pol II mogą prowadzić do większej liczby błędów w transkrypcji, ponieważ zdolność Pol II do korekty jest kwestionowana” – powiedzieli.
Cofanie zegara
Jeśli Pol II w trybie overdrive przyczynia się do starzenia, czy możemy je spowolnić — a tym samym zwalczyć starzenie?
W jednym teście zespół wykorzystał dwie dobrze znane metody leczenia opóźniające starzenie: hamowanie sygnalizacji insulinowej i ograniczenie kalorii. U robaków, much i myszy genetycznie zaburzona ścieżka wykrywania insuliny spowolniła tempo Pol II. Przejście na dietę myszy we wczesnej dorosłości i średnim wieku – ale nie w podeszłym wieku – również zahamowało Pol II.
Kolejny test dotyczył ostatecznego pytania: czy przyspieszenie Pol II napędza starzenie się? Tutaj zespół wyśledził hordę genetycznie zmodyfikowanych robaków i muszek owocowych niosących mutacje, które zmniejszają ich prędkość Pol II. W porównaniu z niemutantami, oba zmodyfikowane szczepy wydłużyły swoje życie o 10 do 20 procent.
Kiedy jednak zespół użył CRISPR-Cas9 do odwrócenia mutacji Pol II u robaków, ich długość życia skróciła się i dorównała rówieśnikom typu dzikiego. Wygląda na to, że Pol II jest przyczyną starzenia się, wyjaśniają autorzy.
Dlaczego?
Zagłębiając się w mechanizm transkrypcji, zespół znalazł jedną odpowiedź. Pamiętaj: DNA jest zawinięte w pęczki boczku i szparagów, znane naukowo jako nukleosomy. Porównując ludzkie komórki żyły pępowinowej i komórki płuc, zespół odkrył, że w miarę starzenia się komórek wiązki powoli się rozwijają i rozpadają. To znacznie ułatwia Pol II przesuwanie się po nici DNA, co z kolei powoduje przyspieszenie transkrypcji.
Po dalszym testowaniu swojej teorii zespół genetycznie wstawił dwa rodzaje białek histonowych – szparagową część wiązki nukleosomów – aby utworzyć więcej nukleosomów w ludzkich komórkach na płytkach Petriego. To z kolei stworzyło dodatkowe progi zwalniające dla Pol II i spowolniło go.
Zadziałało. Komórki z dodatkowymi białkami histonowymi miały mniejsze szanse na przekształcenie się w starzejące się komórki zombie. U muszek owocówek, popularnego modelu do badań nad długowiecznością, modyfikacja genetyczna dała im zauważalny wzrost długości życia.
Chociaż jest jeszcze bardzo wcześnie, wyniki są świetną wiadomością dla potencjalnych poszukiwań nowej klasy leków przeciwstarzeniowych. Pol II był szeroko badany w terapii raka, a wiele leków zostało już przetestowanych i zatwierdzonych, co daje szansę na zmianę przeznaczenia leków do badań nad długowiecznością.
„W sumie przedstawione tutaj dane ujawniają mechanizm molekularny przyczyniający się do starzenia i służą jako środek do oceny wierności maszynerii komórkowej podczas starzenia i choroby” – powiedział zespół.
Kredytowych Image: David Bushnell, Ken Westover i Roger Kornberg, Galeria obrazów Uniwersytetu Stanforda/NIH
- Dystrybucja treści i PR oparta na SEO. Uzyskaj wzmocnienie już dziś.
- Platoblockchain. Web3 Inteligencja Metaverse. Wzmocniona wiedza. Dostęp tutaj.
- Wybijanie przyszłości w Adryenn Ashley. Dostęp tutaj.
- Źródło: https://singularityhub.com/2023/04/18/this-longevity-study-across-5-species-found-a-new-pathway-to-reverse-aging/
- :ma
- :Jest
- $W GÓRĘ
- 10
- 70
- a
- zdolność
- Zdolny
- Gromadź BTC
- w poprzek
- Dodatkowy
- zaawansowany
- Ages
- Starzenie się
- Wszystkie kategorie
- wzdłuż
- już
- alternatywny
- Chociaż
- i
- Inne
- odpowiedź
- osobno
- zatwierdzony
- SĄ
- POWIERZCHNIA
- na około
- AS
- oceniając
- powiązany
- At
- Autorzy
- z powrotem
- Łazienka
- Gruntownie
- BE
- bo
- staje
- być
- Blokować
- krew
- ciało
- podnieść
- Wzmocnione
- zwiększa
- Mózg
- przerwa
- przerwy
- Budowanie
- by
- nazywa
- CAN
- Rak
- terapia przeciwnowotworowa
- Pojemność
- Spowodować
- Komórki
- zakwestionowany
- szansa
- zmiana
- klasa
- Kliniczne
- zwalczania
- w porównaniu
- porównanie
- skomplikowane
- wszechstronny
- przyczyniając
- pokryty
- stworzony
- kredyt
- krytyczny
- dane
- głębiej
- dostarczyć
- Dieta
- różne
- straszny
- choroba
- DNA
- na dół
- napęd
- Narkotyki
- podczas
- Wcześnie
- łatwiej
- faktycznie
- kończy się
- energia
- inżynier
- Wchodzę
- Cały
- Środowisko
- błąd
- Błędy
- Parzyste
- Każdy
- Badanie
- wyjaśnione
- rozciągać się
- fabryka
- Spadać
- szybciej
- wierność
- wzorzysty
- znalezieniu
- i terminów, a
- Fix
- W razie zamówieenia projektu
- Nasz formularz
- znaleziono
- cztery
- od
- pełny
- fundamentalny
- zyskuje
- gigant
- Go
- Goes
- wspaniały
- Zarządzanie
- Rosnąć
- Have
- pomoc
- tutaj
- Najgorętsze
- W jaki sposób
- Jednak
- HTTPS
- człowiek
- Setki
- tożsamość
- obraz
- Układ odpornościowy
- niemożliwy
- in
- Włącznie z
- wzrastający
- indywidualny
- Informacja
- Inwestycje
- zaangażowany
- IT
- jpg
- Zabić
- znany
- język
- prowadzić
- długość życia
- lubić
- linie
- Wątroba
- miejscowy
- długo
- długowieczność
- maszyny
- zrobiony
- robić
- WYKONUJE
- Dokonywanie
- znacznik
- dopasowane
- materiał
- Materia
- dojrzały
- Może..
- znaczy
- mechanizm
- wiadomości
- Środkowy
- mitochondria
- model
- Cząsteczkowa
- jeszcze
- porusza się
- wielokrotność
- Natura
- Nowości
- aktualności
- dostojnik
- Uwagi
- powieść
- of
- Oferty
- Stary
- on
- ONE
- otwiera
- Inne
- ludzkiej,
- własny
- Pokój
- część
- strony
- Przeszłość
- procent
- obraz
- kawałek
- sztuk
- plato
- Analiza danych Platona
- PlatoDane
- w.
- basen
- Popularny
- potencjał
- potencjalnie
- uprawnienia
- Przygotować
- przedstawione
- poprzedni
- Problem
- wygląda tak
- obiecujący
- dowód
- Ochronny
- Białko
- Białka
- że
- Putting
- puzzle
- pytanie
- SZCZUR
- ceny
- raczej
- Czytaj
- gotowy
- zmniejszyć
- pamiętać
- Badania naukowe
- rezerwować
- ograniczenie
- Efekt
- ujawniać
- rewers
- Ryzyko
- RNA
- Walcowane
- w przybliżeniu
- Powiedział
- taki sam
- Naukowcy
- wydawało się
- wydaje
- wyrok
- sekwencjonowanie
- służyć
- pokazać
- Krzem
- Silicon Valley
- pojedynczy
- suwak
- powolny
- Powoli
- kilka
- Typ przestrzeni
- prędkość
- prędkości
- Gwiazda
- Stan
- Steam
- trzon
- Komórki macierzyste
- Ewolucja krok po kroku
- Nadal
- Odmiany Konopi
- badania naukowe
- Badanie
- potykając
- sukces
- niespodzianka
- sydney
- objawy
- system
- trwa
- Podsłuchu
- zespół
- test
- Testowanie
- że
- Połączenia
- Informacje
- ich
- Im
- tysiące
- ciasno
- do
- Przekształcać
- leczenie
- Trend
- wyzwalanie
- SKRĘCAĆ
- Obrócenie
- twist
- typy
- ostateczny
- zrozumienie
- uniwersalny
- Rozwijać
- używany
- Dolina
- wersja
- Zobacz i wysłuchaj
- Wieś
- sposoby
- znane
- który
- Podczas
- KIM
- cały
- w
- pracował
- robak
- robaki
- Owinięty
- wu
- lat
- zefirnet