Наше понимание внутренней работы человеческого мозга долгое время сдерживалось практическими и этическими трудностями наблюдения за развитием, соединением и взаимодействием человеческих нейронов. Сегодня, в нового исследования опубликованной в природа, нейробиологи Стэнфордского университета во главе с Серджиу Пашка сообщают, что они нашли новый способ изучения нейронов человека — путем пересадки мозгоподобной ткани человека крысам, которым всего несколько дней от роду, когда их мозг еще не полностью сформировался. Исследователи показывают, что человеческие нейроны и другие клетки мозга могут расти и интегрироваться в мозг крысы, становясь частью функциональной нейронной схемы, которая обрабатывает ощущения и контролирует аспекты поведения.
Используя эту технику, ученые смогут создавать новые живые модели для широкого спектра нарушений развития нервной системы, включая, по крайней мере, некоторые формы расстройств аутистического спектра. Эти модели будут столь же практичны для нейробиологических лабораторных исследований, как и современные модели животных, но они будут лучше заменять человеческие расстройства, поскольку они будут состоять из реальных человеческих клеток в функциональных нейронных цепях. Они могут стать идеальной мишенью для современных инструментов нейронауки, которые слишком инвазивны для использования в реальном человеческом мозгу.
«Этот подход является шагом вперед в этой области и предлагает новый способ понимания нарушений функционирования нейронов.," сказал Мэдлин Ланкастер, нейробиолог из Лаборатории молекулярной биологии MRC в Кембридже, Великобритания, который не участвовал в работе.
Работа также знаменует новую захватывающую главу в использовании нейронных органоидов. Почти 15 лет назад биологи обнаружили, что стволовые клетки человека могут самоорганизовываться и превращаться в маленькие сферы, содержащие различные типы клеток и напоминающие ткань мозга. Эти органоиды открыли новое окно в деятельность клеток мозга, но это представление имеет свои пределы. В то время как нейроны в тарелке могут соединяться друг с другом и общаться электрически, они не могут образовывать действительно функциональные цепи или достигать полного роста и вычислительной мощности здоровых нейронов в их естественной среде обитания, мозге.
Новаторская работа Различные исследовательские группы доказали много лет назад, что органоиды человеческого мозга могут быть введены в мозг взрослых крыс и выжить. Но новое исследование впервые показывает, что развивающийся мозг новорожденной крысы будет принимать человеческие нейроны и позволять им созревать, а также интегрировать их в локальные цепи, способные управлять поведением крысы.
Пашка указал, что существует «тысяча причин полагать, что это не сработает», учитывая резкие различия в том, как и когда развиваются нервные системы двух видов. И все же это сработало: человеческие клетки нашли подсказки, необходимые им для установления необходимых связей.
«Это очень необходимое и элегантное исследование, которое направляет область в правильном направлении поиска подходов для повышения физиологической значимости органоидов человеческого мозга для моделирования более поздних стадий развития человеческого мозга», — сказал он. Джорджия Квадрато, нейробиолог из Университета Южной Калифорнии.
Понимание клеточных и молекулярных процессов, которые нарушаются в нейронах и приводят к мозговым расстройствам, всегда было мотивацией Пашки. [Примечание редактора: см. сопровождающее интервью с Пашкой о его жизни, карьере и мотивах его работы.] Поскольку многие психические и неврологические расстройства укореняются в мозге во время развития — даже если симптомы могут проявиться только спустя годы — наблюдение за развитием нейронов кажется лучшим способом заполнить пробелы в нашем понимании. Вот почему целью Пашки было пересадить органоиды человеческого мозга новорожденным крысам с тех пор, как он начал работать с нейронами в чашке 13 лет назад.
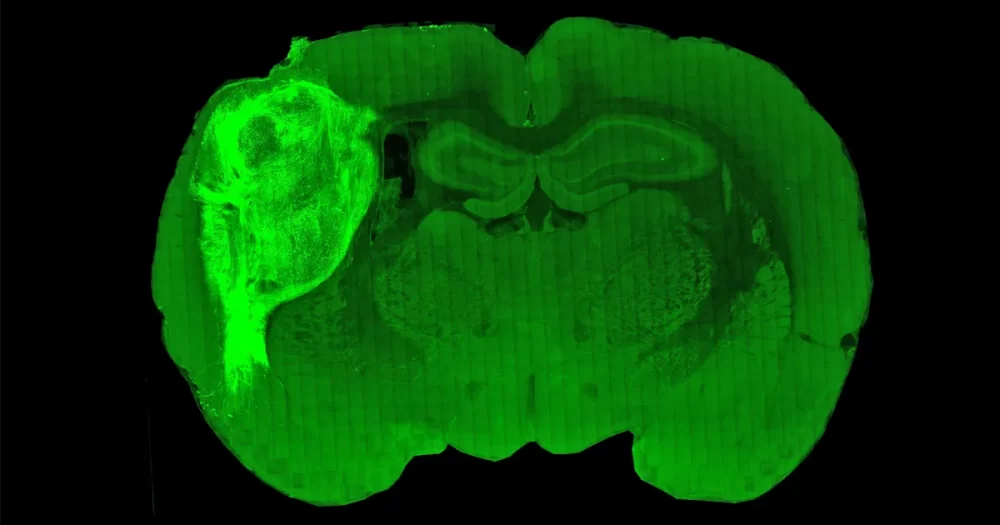
В новой работе, которую также возглавляли коллеги Пашки из Стэнфорда Фелисити Гор, Кевин Келли и Омер Рева (в настоящее время работает в Еврейском университете в Иерусалиме) — команда ввела органоиды коры головного мозга человека в соматосенсорную кору очень молодых крысят до того, как у щенков полностью сформировалась схема мозга. Это дало человеческим нейронам возможность получать дальние связи от ключевой области, обрабатывающей входящую сенсорную информацию. Затем исследователи ждали, будет ли органоид расти вместе с остальной частью развивающегося мозга крысы.
«Мы обнаружили, что если мы поместим органоид на этой ранней стадии… он вырастет в девять раз больше, чем был изначально, в течение четырех или пяти месяцев», — сказал Пашка. Это переводится в область мозговой ткани, похожей на человеческую, которая покрывает примерно треть одного из полушарий мозга крысы.
Но даже несмотря на то, что человеческие нейроны остались вместе в области коры головного мозга, куда они были помещены хирургическим путем, исследователи продемонстрировали, что они стали активными частями нейронных схем, расположенных глубоко в мозгу крысы. Большинство пересаженных человеческих нейронов начали реагировать на тактильные ощущения от усов крысы: когда потоки воздуха направлялись на усы, человеческие нейроны становились более электрически активными.
Еще более удивительно, что поток нейронных сигналов может идти и в другом направлении и влиять на поведение. Когда человеческие нейроны стимулировали синим светом (с помощью метода, называемого оптогенетикой), это запускало условное поведение у крыс, которое заставляло их искать награду, чаще облизывая бутылку с водой.
«Это означает, что мы фактически интегрировали человеческие клетки в схему», — сказал Пашка. «Это не изменение схемы. … Просто человеческие клетки теперь являются его частью».
Трансплантированные клетки не полностью имитировали ткани человеческого мозга в новых условиях. Например, они не организовались в ту же многослойную структуру, что и в коре головного мозга человека. (Они также не последовали примеру окружающих крысиных нейронов и не сформировали бочкообразные столбцы, характерные для соматосенсорной коры крыс.) Но отдельные трансплантированные нейроны сохранили многие из нормальных человеческих электрических и структурных свойств.
Клетки воспользовались одним важным преимуществом пребывания внутри мозга: они успешно соединились с сосудистой системой мозга крысы, позволив кровеносным сосудам проникать в ткани для доставки кислорода и гормонов. Пашка объяснил, что отсутствие кровоснабжения считается основной причиной того, что человеческие нейроны, растущие в чашке, обычно не могут полностью созреть, наряду с отсутствием входных сигналов нейронов, которые, вероятно, необходимы для формирования развития. Когда его команда сравнила пересаженные человеческие нейроны с теми, что жили в чашке, они обнаружили, что пересаженные нейроны были в шесть раз больше, а их размер и профиль электрической активности ближе к нейронам из естественной ткани человеческого мозга.
«Есть что-то в окружающей среде in vivo — то есть в питательных веществах и электрических сигналах, которые они получают в мозге, — что переводит человеческие клетки на новый уровень созревания», — сказал Пашка.
Поскольку человеческие нейроны так сильно созрели в мозге крысы, Пашка и его коллеги смогли увидеть необычные различия в развитии органоидов мозга, полученных у людей с генетическим заболеванием, называемым синдромом Тимоти, которое часто вызывает аутизм и эпилепсию. В мозгу крыс трансплантированные человеческие нейроны, несущие гены синдрома Тимоти, выросли аномальными дендритными ветвями, образующими необычные связи. Важно отметить, что некоторые из этих атипичных изменений можно было наблюдать только в нейронах человека, растущих в коре головного мозга крыс, а не в органоидных нейронах в чашке.
Пашка подчеркивает, что до сих пор эти типы тонких изменений в созревающих нейронах, которые влияют на работу мозга и приводят к неврологическим и психическим расстройствам, были в значительной степени скрыты от нас.
«Результаты очень захватывающие, — сказал Беннет Нович, нейробиолог и биолог стволовых клеток из Калифорнийского университета в Лос-Анджелесе. Он отметил, что исследования нервной ткани in vitro по-прежнему будут более быстрыми и практичными для многих типов неврологических исследований и тестов на наркотики, но новая статья «показывает, как выявление зрелых характеристик нейронов человека… по-прежнему лучше всего достигается в условиях in vivo». ».
Пашка надеется, что возможность изучения зрелых человеческих нейронов у крыс, наконец, приблизит методы лечения психических расстройств и неврологических состояний. Другие в этой области тоже надеются. «Если эта стратегия трансплантации органоидов действительно сможет имитировать сигнатуры болезней, это действительно может ускорить наш путь к излечению», — сказал он. Джоэл Бланшар, нейробиолог из Медицинской школы Икана на горе Синай.
Характер новой работы может вызвать вопросы о благополучии и этичности обращения с крысами. По этой причине Пашка и его коллеги с самого начала вели активные дискуссии со специалистами по этике. Как и во всех экспериментах с участием животных, по закону требовалось, чтобы за крысами тщательно следили лаборанты, имеющие право остановить эксперимент в любое время. Но у крыс с трансплантированными органоидами головного мозга не было обнаружено никаких различий в ряде поведенческих и когнитивных тестов.
Инсу Хён, биоэтик из Центра биоэтики Гарвардской медицинской школы, сказал, что у него нет никаких этических опасений по поводу текущих экспериментов. Команда Пашки следовала всем руководящим принципам, разработанным Международным обществом исследований стволовых клеток, регулирующим исследования органоидов человеческого мозга и перенос человеческих клеток животным. «Для меня проблема действительно в понимании: куда вы идете оттуда?» он сказал.
Хена больше беспокоят другие исследовательские группы, которые теперь могут заинтересоваться трансплантацией органоидов человеческого мозга видам, более похожим на наши, например, нечеловеческим приматам. «Вам придется очень интенсивно обсудить на уровне надзора, почему вы имеете право идти на что-то более сложное», — сказал Хён.
Пашка говорит, что он и его коллеги не заинтересованы в таких раздвигающих границы экспериментах. Он также считает, что сложность выращивания и поддержания органоидов для трансплантации будет сдерживать большинство потенциально безрассудных исследований. «Есть несколько мест с инфраструктурой и опытом, необходимыми для этого», — сказал он.
Более неотложные и практические научные задачи заключаются в улучшении органоидов человеческого мозга, которые пересаживают крысам. Бесспорно, до этого еще далеко. В мозгоподобной ткани человека в настоящее время отсутствуют многие важные клетки головного мозга, помимо нейронов, такие как микроглия и астроциты, а также нейроны, участвующие в подавлении активности других нейронов. В настоящее время команда Пашки работает над экспериментами по пересадке «ассемблоидов» — наборов органоидов, представляющих различные области мозга, клетки которых мигрируют и взаимодействуют друг с другом.
Возможно, существуют ограничения на то, насколько данные, полученные на нейронах человека в мозге крысы, можно применить к естественному человеческому мозгу. Крысы, используемые в этих исследованиях трансплантации, рождаются с неисправной иммунной системой из-за генетической мутации. Это делает их хорошо подходящими для трансплантации, поскольку их иммунная система с меньшей вероятностью отвергнет имплантированные человеческие клетки. Но это также означает, что исследования нейродегенеративных заболеваний, таких как болезнь Альцгеймера, которые, как известно, имеют иммунные компоненты, могут оказаться более сложными. И какими бы реалистичными ни казались трансплантированные органоиды человеческого мозга, пока они находятся в мозге крысы, они будут подвергаться воздействию крысиной крови с ее уникальным набором питательных веществ и гормонов, а не человеческой крови. Таким образом, нейробиологи могут изучать системы, которые несколько отстают от реальности внутри человеческого черепа.
Но для Пашки эта новая система дает возможность как никогда приблизиться к истине о том, как измененные нейробиологические процессы вызывают неврологические и психические расстройства. Трансплантация органоидов новорожденным крысам, наконец, предлагает способ использовать все возможности современных инструментов нейронауки в исследованиях развития нейронов и цепей человека.
«Сложные проблемы, такие как понимание психических расстройств, которые являются уникальными человеческими состояниями, потребуют смелых подходов», — сказал Пашка.