Протонная терапия может доставлять высококонформное распределение дозы к опухоли-мишени, минимизируя дозу в тканях за пределами целевого объема. Создание планов лечения, учитывающих эту силу, является главным приоритетом для дозиметристов и медицинских физиков.
Протоны вносят дозу принципиально иначе, чем рентгеновские лучи, еще один тип дистанционной лучевой терапии. Когда протон достигает конца своей траектории, скорость, с которой его энергия передается тканям — его линейная передача энергии (ЛПЭ), выраженная в кэВ/мкм, — увеличивается.
Относительная биологическая эффективность (ОБЭ) отражает биологические последствия повышения ЛПЭ, и для клинического лечения протонами часто применяется фиксированное значение ОБЭ, равное 1.1. Но ОБЭ протона зависит от многих других факторов, включая клинические конечные точки, тип ткани, схему фракционирования, специфическую для пациента радиочувствительность, физическую дозу и погрешности экспериментальных измерений. В результате использование фиксированного значения ОБЭ в протонной терапии, вероятно, занижает ОБЭ в местах с высокой ЛПЭ, что может привести к повышенному риску радиационно-индуцированной токсичности.
Тем не менее, ЛПЭ сильно коррелирует с ОБЭ и является ключевым фактором для определения переменной ОБЭ при протонной терапии. Таким образом, исследователи изучают подходы к расчету и оценке ЛПЭ при планировании лечения. Однако эти инструменты планирования биологического лечения ограничены, и до тех пор, пока они не будут разработаны и изучены дальше, клиники должны определить свои собственные методы планирования лечения, чтобы свести к минимуму ЛПЭ за пределами целевых объемов. Остин Фаут, медицинский физик в Детская исследовательская больница Святого Иуды в Теннесси.
«Как повлиять на [распределение LET] — это активная область исследований, и в настоящее время разрабатываются несколько замечательных методов», — объясняет Фаут. «Проблема, с которой мы сталкиваемся, заключается в том, что они недоступны без специального программного обеспечения, разработанного внутри компании, или с помощью специальных исследовательских версий приложений, предоставляемых поставщиками… [и есть] несколько исследований, дающих количественные рекомендации относительно того, к чему мы должны стремиться».
Стратегии планирования лечения
В качестве шага к оценке и оптимизации плана фотонной терапии на основе LET Фот и его команда провели обзор стратегий планирования, которые коммерчески доступны для клинических групп для протонной терапии с модулированной интенсивностью (IMPT). Их исследование, о котором сообщается в Журнал прикладной клинической медицинской физики, представляет некоторые рекомендации для специалистов по планированию лечения протонной терапией. «Мы хотели изучить некоторые легкодоступные методы планирования лечения и то, как они могут повлиять на ЛПЭ», — объясняет Фаут.
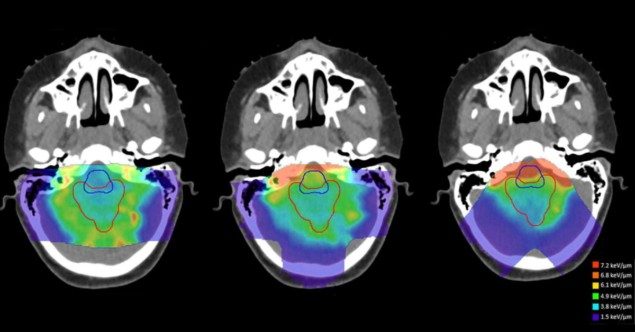
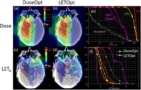
Исследователи оценили различия в дозозависимой ЛПЭ (ЛПЭd) между восемью перспективными подходами к планированию лечения, примененными к цилиндрическому водному фантому, и четырем случаям опухоли головного мозга у детей (Faught отмечает, что токсичность, вызванная радиацией, находится в центре внимания группы). Они сравнили эти стратегии планирования с планом с использованием противоположных боковых лучей (для фантома) или с исходным клиническим планом (для пациентов), используя вторичные расчеты Монте-Карло для оценки как дозы, так и ЛПЭ.d.
Исследователи обнаружили, что геометрия поля лечения была самым большим фактором, влияющим на расположение областей с высокой ЛПЭ. Чтобы смягчить потенциальное влияние биологических неопределенностей, связанных с высокой ЛПЭd, они предполагают, что планировщики лечения используют большие углы пересечения между лучами лечения и избегают лучей, которые останавливаются непосредственно проксимальнее критических структур.
«Это отличная новость, так как это означает, что тщательный выбор количества полей обработки и их ориентация по отношению к близлежащим здоровым тканям могут быть эффективными», — говорит Фаут. «При наличии некоторых сознательных предварительных размышлений это то, что все специалисты по планированию лечения могут принять во внимание в процессе планирования».
Исследователи также обнаружили, что использование переключателя диапазона значительно снижает среднее значение LET.d в клиническом целевом объеме. В результате они рекомендуют экономно использовать переключатели диапазона и альтернативные стратегии ограничения точечного размещения и только тогда, когда клиники могут рассчитать результирующий LET.d для оценки альтернативных стратегий планирования.
Из-за небольшого размера выборки исследователи не смогли установить четкую тенденцию в LET.d вариации клинических случаев. Они не оценивали взаимосвязь между изменениями ЛПЭ и изменением вероятности контроля опухоли или осложнений со стороны нормальных тканей.
Планы на основе LET оптимизируют протонную терапию
Хотя влияние каждого подхода к планированию на регионы с высокой ЛПЭ было скромным, Фот говорит, что важно признать, что стратегии и рекомендации группы по планированию лечения основаны на фактических данных и могут быть легко внедрены в клиническую практику.
«Я надеюсь, что один из выводов заключается в том, что мы, как область, выиграем от коммерческих инструментов, позволяющих рассчитывать ЛПЭ в системе планирования лечения. Более того, мы хотели бы иметь способы оптимизации с учетом LET. Это исследование было хорошим мостом, пока эти инструменты не станут более широко доступными», — говорит Фот.