Возможность объединить электронику и оптические датчики с человеческим телом на уровне отдельных клеток однажды может позволить осуществлять удаленный мониторинг и контроль отдельных клеток в режиме реального времени. Достижения в производстве электроники позволили создавать транзисторы и датчики с наноразмерным разрешением, а инновационные методы наноструктурирования позволяют собирать эти устройства на гибких подложках. Однако такие процессы обычно требуют агрессивных химикатов, высоких температур или вакуумных технологий, которые непригодны для живых клеток и тканей.
Чтобы преодолеть эти препятствия, исследовательская группа из Университета Джонса Хопкинса разработала нетоксичный и экономически эффективный процесс печати золотых наноструктур с высоким разрешением на живых тканях и клетках. Сообщая о своих выводах в Nano LettersОни демонстрируют, что новая техника может «татуировать» живые клетки и ткани гибкими массивами золотых наноточек и нанопроволок. В конечном итоге этот метод можно будет использовать для интеграции интеллектуальных устройств с живой тканью для таких приложений, как бионика и биосенсорство.
«Если бы у нас были технологии для отслеживания здоровья изолированных клеток, мы, возможно, могли бы диагностировать и лечить заболевания гораздо раньше, а не ждать, пока будет поврежден весь орган», — объясняет руководитель группы. Дэвид Грасиас в заявлении для прессы. «Речь идет о нанесении чего-то вроде электронной татуировки на живой объект, размер которого в десятки раз меньше головки булавки. Это первый шаг к прикреплению датчиков и электроники к живым клеткам».
Спасибо, Ло Гу и его коллеги разработали трехэтапный процесс нанотрансферной печати, позволяющий прикрепить наноструктуры золота к живым клеткам. На первом этапе они использовали традиционную наноимпринтную литографию (NIL) для печати массивов золотых наноточек или нанопроволок на кремниевых пластинах с полимерным покрытием. Затем они растворили полимер, освободив наночипы для переноса на покровные стекла.
Затем исследователи функционализировали поверхность золота цистеамином и покрыли золотые NIL-матрицы переносным слоем альгинатного гидрогеля. Они показали, что этот подход позволяет надежно переносить массивы наноточек и нанопроволок размером 8 × 8 мм со стекла на мягкие и гибкие гидрогели. На заключительном этапе золотые NIL-чипы конъюгируют с желатином, чтобы обеспечить их перенос на живые клетки или ткани. После диссоциации трансферного слоя гидрогеля обнажается золотой узор.
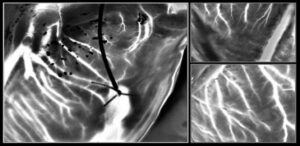
Исследователи исследовали поведение живых клеток фибробластов, высеянных на массивы золотых точек диаметром 250 нм (расстояние между центрами 550 нм) или золотых проволок шириной 300 нм (расстояние 450 нм) на альгинатных гидрогелях. Примерно через 24 часа после посева клетки на гидрогеле, напечатанном нанопроволокой, предпочтительно мигрировали параллельно нанопроволокам, тогда как клетки на наноточках демонстрировали случайную, но немного более быструю миграцию. Клетки на нанонитях также демонстрировали примерно вдвое большее удлинение, чем на наноточках. Эти результаты демонстрируют способность золотых NIL-матриц управлять ориентацией и миграцией клеток.
Альгинатный гидрогель не только биосовместим с клетками и тканями, но и может переносить золотые NIL-матрицы на живые органы и клетки. Чтобы продемонстрировать это, исследователи поместили гидрогели, напечатанные нанопроволокой, на кору головного мозга всего мозга и корональный срез мозга.
После 2 часов пребывания в культуральной среде и диссоциации гидрогеля нанопроволоки оставались связанными с поверхностью всего мозга. Напротив, нанопроволоки на срезе мозга не прикрепились, что позволяет предположить, что сила адгезии варьируется в зависимости от типа клеток и методов культивирования. Исследователи отмечают, что необходимы дальнейшие исследования для характеристики и оптимизации механизмов адгезии для надежного долговременного соединения.
Наконец, чтобы оценить биотрансферную печать на уровне отдельных клеток, исследователи культивировали однослойные клеточные листы на альгинатных гидрогелях, напечатанных с использованием золотого NIL-матрицы. Через 24 часа они перевернули гидрогели с засеянными фибробластами на покровные стекла, покрытые желатином, и оставили клетки прикрепляться к покровным стеклам на ночь.
После диссоциации альгинатного гидрогеля флуоресцентная микроскопия показала, что фибробласты с рисунком из золотых наноточек имели жизнеспособность примерно 97%, тогда как фибробласты с рисунком из нанопроволок имели жизнеспособность примерно 98%, что указывает на то, что процесс печати биосовместим с живыми клетками. Светоотражающие цвета, видимые на узорчатом листе клеток фибробластов, позволяют предположить, что форма золотого NIL-матрицы сохранилась.
Процесс изготовления также совместим с микромасштабной фотолитографией, которая позволила исследователям создавать шестиугольные и треугольные участки шириной 200 мкм из золотых NIL-матриц. Затем они напечатали их с помощью биотрансфера на клеточные листы, что привело к избирательному росту клеток фибробластов на микропатчах. Видео, записанные в течение 16 часов, показали, что клетки с напечатанными сверху участками нанопроводов выглядели здоровыми и способными мигрировать, при этом массивы оставались на мягких клетках даже во время их движения.

Крошечный датчик одновременно измеряет электрическую и механическую активность клеток сердца
«Мы показали, что можем прикреплять сложные наноструктуры к живым клеткам, гарантируя при этом, что клетка не умрет», — говорит Грасиас. «Это очень важный результат: клетки могут жить и двигаться вместе с татуировками, потому что часто существует значительная несовместимость между живыми клетками и методами, которые инженеры используют для изготовления электроники».
Грасиас и его коллеги приходят к выводу, что их процесс наноструктурирования в сочетании со стандартными методами микропроизводства «открывает возможности для разработки новых субстратов клеточных культур, биогибридных материалов, бионических устройств и биосенсоров». Далее они планируют попытаться прикрепить более сложные наносхемы, которые смогут оставаться на месте в течение более длительного периода времени, а также поэкспериментировать с различными типами клеток.
- SEO-контент и PR-распределение. Получите усиление сегодня.
- PlatoData.Network Вертикальный генеративный ИИ. Расширьте возможности себя. Доступ здесь.
- ПлатонАйСтрим. Интеллект Web3. Расширение знаний. Доступ здесь.
- ПлатонЭСГ. Автомобили / электромобили, Углерод, чистые технологии, Энергия, Окружающая среда, Солнечная, Управление отходами. Доступ здесь.
- ПлатонЗдоровье. Биотехнологии и клинические исследования. Доступ здесь.
- ЧартПрайм. Улучшите свою торговую игру с ChartPrime. Доступ здесь.
- Смещения блоков. Модернизация права собственности на экологические компенсации. Доступ здесь.
- Источник: https://physicsworld.com/a/researchers-tattoo-gold-nanopatterns-onto-live-cells/
- :имеет
- :является
- :нет
- $UP
- 16
- 200
- 24
- 8
- a
- способность
- в состоянии
- О нас
- деятельность
- придерживаться
- авансы
- После
- причислены
- среди
- an
- и
- появившийся
- Приложения
- подхода
- примерно
- МЫ
- около
- массив
- AS
- сборка
- оценить
- At
- прикреплять
- BE
- , так как:
- не являетесь
- между
- тело
- связь
- Мозг
- но
- CAN
- Клетки
- охарактеризовать
- нажмите на
- коллеги
- сочетании
- совместим
- комплекс
- вывод
- контраст
- контроль
- обычный
- рентабельным
- может
- Создайте
- Культура
- день
- демонстрировать
- предназначенный
- развитый
- Развитие
- Устройства
- DID
- Умереть
- различный
- заболеваний
- не
- Ранее
- Электронный
- Electronics
- включить
- включен
- Инженеры
- обеспечение
- Весь
- Даже
- Объясняет
- быстрее
- окончательный
- результаты
- Во-первых,
- гибкого
- Что касается
- от
- далее
- GAO
- в общем
- стекло
- Золото
- Рост
- инструкция
- было
- Есть
- Медицина
- здоровый
- Сердце
- High
- высокое разрешение
- Hopkins
- Однако
- HTTPS
- человек
- изображение
- важную
- in
- individual
- информация
- инновационный
- интегрировать
- изолированный
- вопрос
- IT
- Johns
- Университет Джонса Хопкинса
- JPG
- слой
- лидер
- ведущий
- позволять
- уровень
- такое как
- жить
- жизнью
- долгосрочный
- дольше
- сделанный
- материалы
- макс-ширина
- может быть
- меры
- механический
- механизмы
- Медиа
- идти
- метод
- методы
- Микроскопия
- мигрировать
- мигрировали
- миграция
- Мониторинг
- БОЛЕЕ
- двигаться
- переехал
- Кино
- много
- необходимый
- Новые
- следующий
- объект
- препятствиями
- of
- .
- on
- ONE
- на
- открытый
- Возможности
- Оптимизировать
- or
- за
- Преодолеть
- всю ночь
- Параллельные
- Патчи
- шаблон
- периодов
- Физика
- Мир физики
- Часть
- план
- Платон
- Платон Интеллектуальные данные
- ПлатонДанные
- расположены
- возможное
- нажмите
- Печать / PDF
- печать
- процесс
- Процессы
- Полагая
- случайный
- RAT
- реальные
- реального времени
- записанный
- остались
- осталось
- удаленные
- Reporting
- требовать
- исследованиям
- исследователи
- Постановления
- результат
- Показали
- надежный
- грубо
- говорит
- видел
- селективный
- датчик
- Форма
- лист
- показал
- показанный
- значительный
- кремний
- одновременно
- Ломтик
- меньше
- умный
- мягкая
- удалось
- стандарт
- заявление
- оставаться
- Шаг
- прочность
- исследования
- такие
- предлагать
- Поверхность
- говорить
- команда
- снижения вреда
- технологии
- десятки
- чем
- который
- Ассоциация
- их
- тогда
- Эти
- они
- этой
- те
- миниатюрами
- время
- раз
- в
- топ
- к
- трек
- перевод
- лечить
- правда
- стараться
- Дважды
- Типы
- В конечном счете
- Университет
- до
- использование
- используемый
- вакуум
- очень
- жизнеспособность
- ждать
- законопроект
- we
- ЧТО Ж
- в то время как
- который
- в то время как
- все
- широкий
- Мир
- зефирнет