Представьте себе армию самодвижущихся, покрытых радиоизотопами частиц, которые в 2500–10,000 XNUMX раз меньше пылинки, которые при попадании в тело ищут раковые опухоли и прикрепляются к ним, уничтожая их. Звучит как научная фантастика? Не так обстоит дело с мышами с раком мочевого пузыря.
Исследователи из Испании сообщают, что наночастицы, содержащие радиоактивный йод и которые перемещаются при реакции с мочевиной, обладают способностью отличать раковые опухоли мочевого пузыря от здоровых тканей. Эти «наноботы» проникают во внеклеточный матрикс опухоли и накапливаются внутри него, позволяя радионуклидной терапии достичь точной цели. В исследовании, проведенном в Институт биоинженерии Каталонии (IBEC) в Барселоне, у мышей, получивших однократную дозу этого препарата, наблюдалось уменьшение размера опухолей мочевого пузыря на 90% по сравнению с животными, не получавшими лечения.
Этот новый подход может однажды произвести революцию в лечении рака мочевого пузыря. По данным Глобальной онкологической обсерватории Всемирной организации здравоохранения, рак мочевого пузыря является десятым по распространенности видом рака в мире: в 600,000 году было диагностировано более 2022 220,000 новых случаев и более XNUMX XNUMX случаев смерти во всем мире.
Неинвазивный рак мочевого пузыря, на долю которого приходится 75% случаев, в настоящее время лечится путем резекции опухоли с последующим внутрипузырным введением в мочевой пузырь химиотерапевтических или иммунотерапевтических препаратов. Однако доставка лекарств является особенно сложной задачей из-за низкой проницаемости уротелия (ткани, выстилающей внутреннюю часть мочевыводящих путей), наполнения мочи содержимым и последующего вымывания лекарств. Этот процесс также неудобен для пациентов, поскольку им приходится время от времени поворачивать тело, лежа на животе, чтобы лекарства могли достичь всех сторон стенки мочевого пузыря. После лечения риск рецидива в течение пяти лет составляет 30–70%.
Для улучшения клинических результатов главный исследователь Самуэль Санчес и его коллеги стремятся разработать инновационные и более эффективные методы лечения рака мочевого пузыря и в процессе снизить частоту рецидивов. Кроме того, однократная терапия позволит значительно снизить стоимость лечения, которое в настоящее время требует от шести до 14 госпитализаций.
Команда создала наноботов из наночастиц мезопористого кремнезема с различными функциональными компонентами на поверхности. К ним относятся радиоизотопы для ПЭТ-визуализации или радионуклидной терапии, а также белок уреаза, который реагирует с мочевиной в моче и обеспечивает движение нанобота.
Запись в Природа НанотехнологияИсследователи сообщают, что когда они добавили каплю наноботов в раствор, содержащий 300 мМ мочевины, нанороботы начали двигаться, образуя активные и энергичные фронты и трехмерные вихри. Без мочевины нанороботы просто оседали возле места добавления.
Чтобы проверить, могут ли наноботы добраться до опухоли. в естественных условиях, команда оценила их поведение на мышах с опухолями. Изображения позитронно-эмиссионной томографии (ПЭТ) показали, что сигналы от меченных радиоактивным изотопом наноботов были совмещены с положением опухоли, определенным с помощью МРТ, при этом радиоактивность в первую очередь наблюдалась в целевом участке опухоли. Только у мышей, которым вводили наноботы плюс мочевину, наблюдалось значительное накопление опухолевой массы – наноботы, доставленные в воде, и контрольные наночастицы (без уреазы), введенные в воде или мочевине, демонстрировали минимальное поглощение опухолью.
Исследователи предполагают, что мобильность нанороботов помогает им проникать в опухолевую массу. «У наноботов отсутствуют специфические антитела для распознавания опухоли, а опухолевая ткань обычно более жесткая, чем здоровая ткань, но в случае опухолей мочевого пузыря это не так», — объясняет соавтор. Меритчель Серра Касабланкас МБЭС. «Мы заметили, что эти нанороботы могут разрушать внеклеточный матрикс опухоли, локально повышая pH посредством самодвижущейся химической реакции. Это явление способствовало более глубокому проникновению опухоли». Исследователи полагают, что наноботы сталкиваются с уротелием, как если бы это была стена, но проникают в губчатую опухоль.
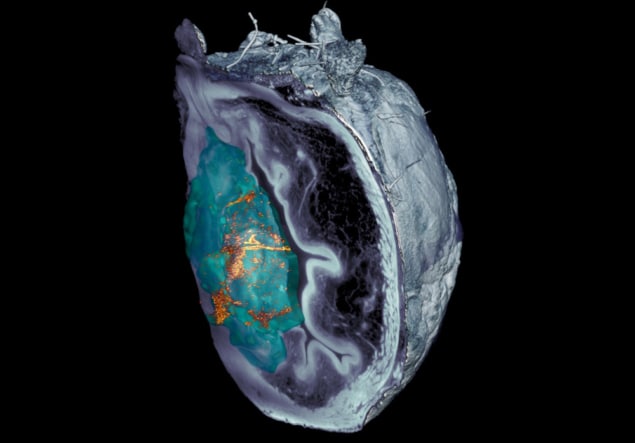
Команда отмечает, что идентифицировать нанороботов на изображениях рассеченной ткани, полученных при микроскопии, было непросто. После того, как методы конфокальной оптической микроскопии потерпели неудачу, исследователи из IRB Барселона разработали систему микроскопии на основе светового листа, основанную на планарном лазерном освещении, способную сканировать различные слои мочевого пузыря и создавать трехмерную реконструкцию всего органа.
«Разработанная нами система микроскопии с рассеянным эластичным световым листом позволила нам устранить свет, отраженный самой опухолью, что позволило нам идентифицировать и локализовать наночастицы по всему органу без предварительной маркировки с беспрецедентным разрешением», — говорит Жюльен Коломбелли от IRB Барселона.

Сконструированные бактерии привлекают убивающие рак радиоизотопы в опухоли
Чтобы оценить терапевтический эффект метода, команда пометила наноботов йодом-131 (131I, радиоизотоп, обычно используемый для радионуклидной терапии), и вводили их мышам с опухолями. Лечение с потерей дозы 131I-наноботы в мочевине остановили рост опухоли, а высокие дозы 131I-наноботы, введенные в мочевину, привели к уменьшению объема опухоли почти на 90% по сравнению с животными, не получавшими лечения.
Санчес рассказывает Мир физики что следующими шагами команды будут инкапсулирование небольших лекарств, которые в настоящее время используются в химиотерапии, и продолжение проверки эффективности нанороботов в качестве носителей лекарств. В конечном итоге они намерены расширить масштабы использования нанороботов и изучить пути регулирования, чтобы перейти к первым клиническим испытаниям в ближайшие три-четыре года через дочернюю компанию IBEC. Наноботы Терапия.
- SEO-контент и PR-распределение. Получите усиление сегодня.
- PlatoData.Network Вертикальный генеративный ИИ. Расширьте возможности себя. Доступ здесь.
- ПлатонАйСтрим. Интеллект Web3. Расширение знаний. Доступ здесь.
- ПлатонЭСГ. Углерод, чистые технологии, Энергия, Окружающая среда, Солнечная, Управление отходами. Доступ здесь.
- ПлатонЗдоровье. Биотехнологии и клинические исследования. Доступ здесь.
- Источник: https://physicsworld.com/a/self-propelling-nanobots-shrink-bladder-tumours-in-mice-by-90/
- :является
- :нет
- $UP
- 000
- 10
- 135
- 14
- 2022
- 220
- 300
- 3d
- 600
- a
- способность
- По
- Учетные записи
- скапливаться
- накопление
- активный
- добавленный
- дополнение
- Дополнительно
- вводить
- После
- цель
- Все
- Позволяющий
- причислены
- an
- и
- животные
- подхода
- МЫ
- армия
- за участие
- AS
- оценивается
- At
- прикреплять
- привлекать
- автор
- Бактерии
- Барселона
- основанный
- поведение
- верить
- между
- органов
- тело
- Ломать
- но
- by
- CAN
- рак
- способный
- носители
- случаев
- случаев
- сложные
- химический
- Клинический
- клинические испытания
- коллеги
- сталкиваться
- COM
- Общий
- обычно
- сравненный
- компоненты
- проводятся
- содержание
- продолжать
- контроль
- Цена
- создали
- Создающий
- В настоящее время
- день
- смерть
- поставляется
- поставка
- определены
- развивать
- развитый
- различный
- выделить
- дозировать
- вниз
- наркотик
- Наркотики
- два
- Пыли
- эффект
- Эффективный
- затрат
- ликвидировать
- излучение
- включить
- включен
- позволяет
- позволяет
- Весь
- EU
- оценивать
- со временем
- исследовать
- экспонировались
- Объясняет
- Oшибка
- Рассказы
- заполнение
- Во-первых,
- 5
- следует
- после
- Что касается
- 4
- от
- функциональная
- Глобальный
- ГЛОБАЛЬНО
- большой
- Рост
- было
- Есть
- Медицина
- здоровый
- помогает
- Однако
- HTTPS
- определения
- идентифицирующий
- if
- изображений
- иммунотерапия
- улучшать
- in
- включают
- повышение
- информация
- инновационный
- внутри
- намереваться
- в
- вопрос
- IT
- ЕГО
- саму трезвость
- JPG
- навешивания ярлыков
- Отсутствие
- лазер
- слоев
- привело
- легкий
- такое как
- подкладка
- в местном масштабе
- Низкий
- Масса
- матрица
- макс-ширина
- Май..
- Микроскопия
- минимальный
- мобильность
- БОЛЕЕ
- самых
- движение
- двигаться
- МРТ
- природа
- Возле
- почти
- Необходимость
- Новые
- следующий
- в своих размышлениях
- роман
- обсерватория
- of
- on
- ONE
- только
- or
- Результаты
- за
- особенно
- пути
- пациентов
- проникновение
- явление
- Физика
- Мир физики
- Платон
- Платон Интеллектуальные данные
- ПлатонДанные
- плюс
- должность
- необходимость
- в первую очередь
- Основной
- Предварительный
- процесс
- приводить в движение
- силовая установка
- Белкове продукты
- Стоимость
- достигать
- реакция
- Реагирует
- получение
- признать
- повторение
- уменьшить
- снижение
- отметила
- регуляторы
- отчету
- требуется
- исследователи
- Постановления
- революционизировать
- Снижение
- говорит
- Шкала
- сканирование
- рассеянный
- Наука
- Научная фантастика
- Поиск
- видел
- показал
- Стороны
- сигналы
- существенно
- просто
- одинарной
- сайте
- ШЕСТЬ
- Размер
- небольшой
- меньше
- So
- Решение
- звуки
- Испания
- конкретный
- Шаги
- Кабинет
- последующее
- существенный
- предлагать
- система
- цель
- команда
- снижения вреда
- говорит
- тестXNUMX
- чем
- который
- Ассоциация
- мир
- их
- Их
- сами
- терапия
- Эти
- они
- этой
- три
- трехмерный
- Через
- по всему
- миниатюрами
- раз
- в
- к
- лечение
- лечение
- лечение
- испытания
- правда
- ОЧЕРЕДЬ
- типично
- беспрецедентный
- на
- поглощение
- us
- используемый
- различный
- с помощью
- визуализация
- объем
- стена
- законопроект
- Вода
- we
- были
- когда
- будь то
- , которые
- в то время как
- в
- без
- Мир
- бы
- лет
- зефирнет